На уровне химических реакций и клеток процессы жизнедеятельности имеют сложные механизмы саморегуляции. Саморегуляция обеспечивает устойчивость химической системы при изменении внешних условий. Саморегуляция биохимических реакций осуществляется по общему кибернетическому принципу — с помощью прямой и обратной связи. Основное назначение механизмов регуляции — поддержание концентраций различных веществ в клетках на уровне, определяемом потребностями клеток.
Стационарное состояние. Стационарным состоянием реакции
 |
называется такое состояние, при котором субстрат поступает с точно такой же скоростью, с какой он
112
используется в реакции. Как уже отмечалось в главах 1 и 2, свойство саморегуляции присуще самим химическим реакциям в стационарном состоянии в соответствии с принципом Ле-Шателье — Брауна. При изменении внешних условий (температуры, давления, концентрации веществ и пр.) скорость реакции изменяется таким образом, чтобы по возможности устранить эффект этого изменения условий. Так, при чрезмерном увеличении концентрации продукта возрастает скорость обратной реакции, что препятствует дальнейшему росту концентрации продукта. Наоборот, при уменьшении концентрации продукта (при интенсивном его использовании) в соответствии с законом действующих масс скорость обратной реакции понижается и выход конечных продуктов реакции увеличивается.
Большое значение в регулировании химических реакций имеет проницаемость клеточных и цитоплазматических мембран. Изменение проницаемости и, следовательно, скорости поступления и выведения вещества эквивалентно изменению скорости какой-либо стадии превращения вещества внутри клетки, что может вызвать переход системы на другой стационарный уровень. Изменение активности ферментов. Поскольку большинство биохимических реакций катализируется ферментами, то наиболее эффективные механизмы регуляции скоростей этих реакций заключаются в изменении активности, а также концентрации ферментов.
Если имеется последовательная реакция, то между конечной и начальной стадиями этой реакции может устанавливаться обратная связь. Она заключается в том, что продукты реакции влияют на активность ферментов первых стадий превращения (рис. 17). Обратная связь может быть положительной и отрицательной. При положительной обратной связи продукт реакции усиливает активность ферментов в первых стадиях превращения. В данном случае продукт реакции является активатором ферментов. К этому же типу можно отнести и аутокаталитические реакции, в которых продукт реакции сам является катализатором. При данном типе регулирования за счет положительной обратной связи реакции сильно ускоряется и за короткий промежуток времени достигается максимальная ее скорость.
Явление отрицательной обратной связи в химических превращениях, открытое Умбаргером в 1961 г., заклю-
Медицинская биофизика
113
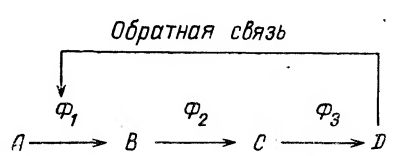 |
Рис. 17. Схема регулирования скорости реакции путем изменения
активности ферментов. Ф1, Ф2, Ф3 — ферменты.
чается в том, что продукты реакции подавляют активность ферментов начальных стадий. В данном случае продукты реакции являются ингрибиторами ферментов. Различают два вида ингибирования — аллостерическое и конкурентное. Аллостерическое ингибирование заключается в том, что молекула ингибитора присоединяется к ферменту на участке, не являющимся активным центром для субстрата. В результате этого изменяется трехмерная структура фермента; активный центр, предназначенный для субстрата, деформируется и утрачивает каталитическую способность. Конкурентное ингибирование при реакции заключается в присоединении молекулы ингибитора к активному центру фермента, предназначенному для субстрата, что приводит к инактивации фермента. Обычно ингибирование конечным продуктом протекает по типу аллостерического ингибирования, так как конкурентное ингибирование в данном случае является невозможным, поскольку продукт реакции — ингибитор — структурно отличается от субстрата. Ингибирование ферментов продуктами реакции препятствует образованию избытка метаболитов. Отрицательная обратная связь стабилизирует реакцию, поддерживая выход продуктов на определенном уровне.
Общая теория аллостерической регуляции ферментативного действия была разработана Моно, Шанже и Жакобом в 1963 г. Они показали, что в общем случае регуляторный фермент имеет три активных центра: к первому присоединяется субстрат, ко второму — аллостерический ингибитор, к третьему — аллостерический активатор. При этом второй и третий центры могут быть представлены одной и той же структурой.
Индукция и репрессия синтеза ферментов. Явления индукции и репрессии синтеза ферментов были открыты Жакобом и Моно у бактерий. Затем эти представления были распространены и на другие организмы.
114
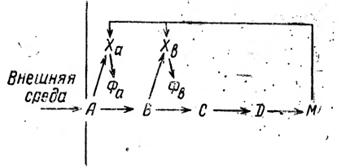
Рис. 18. Общая схема индукции и репрессии синтеза ферментов
(объяснения в тексте).
В общих чертах явление индукции синтеза ферментов заключается в следующем: когда из внешней среды в клетку попадает какое-то питательное вещество А (рис. 18), то оно действует. на ферментообразующую систему Ха , продуцирующую фермент Ф а, который превращает вещество А в вещество В. Вещество В действует на свою ферментообразующую систему Х b и индуцирует синтез фермента Ф b, превращающего вещество В в вещество С и т. д.
С помощью механизма индукции регулируется концентрация фермента в соответствии с концентрацией субстрата. Если субстрат в клетке отсутствует, то отсутствует и фермент, превращающий данный субстрат в другое вещество. При поступлении субстрата в клетку осуществляется синтез соответствующего фермента в количестве, пропорциональном количеству поступившего субстрата.
Явление репрессии синтеза ферментов заключается в том, что вещества, образующиеся в конечной стадии процесса, репрессируют синтез фермента одной изначальных стадий. Так, вещество М (см. рис. 18) может действовать на ферментообразующие системы Ха и Х b и подавлять синтез ферментов Фа и Ф b, в результате чего весь процесс превращения прекращается.
Например, аргинин подавляет образование двух ферментов на пути к его синтезу. С помощью механизма репрессии осуществляется прекращение процесса, когда образовалось нужное для потребностей клетки количество вещества.
Вероятно, механизмы индукции и репрессии синтеза ферментов лежат в основе регуляции потока информации от ДНК в клетку, что обусловливает рост, развитие и дифференцировку клеток, а также адаптацию к условиям среды.
8*
115
Рассмотренные механизмы регуляции биохимических реакций наблюдаются на молекулярном и клеточном уровнях организации. На уровне целого организма биохимические реакции регулируются эндокринной и нервной системами. Молекулярные механизмы нервной и гормональной регуляции биохимических реакций в настоящее время изучены слабо. Имеются данные, что одна группа гормонов оказывает регулирующие воздействия на клетки путем изменения активности ферментов, другая группа — путем индуцирования синтеза ферментов и, наконец, третья группа гормонов изменяет проницаемость клеточных и цитоплазматических мембран.
Процесс обмена веществ представляет собой сложную сеть биохимических процессов, которая образована последовательными, параллельными и циклическими реакциями. Все эти реакции строго связаны друг с другом, что создает возможность для тонкой адаптации к условиям среды. В организме все вещества подвергаются непрерывным изменениям и все они тем или иным образом входят в сеть обмена веществ. В организме нет ни одного вещества, которое бы не входило в обменные процессы (за исключением инертных газов).
Между двумя стадиями химических превращений может существовать несколько путей реакций. Реакции обычно протекают по тому пути, который обеспечивает максимальную скорость превращения веществ в данных условиях. Это положение известно под названием принципа Хиншельвуда. Знание этого принципа имеет большое значение для определения направления химических превращений в сложных сопряженных системах реакций.
Вся сеть биохимических процессов в целом представляет собой открытую систему, в которую из внешней среды постоянно поступают вещества, претерпевают в ней различные химические превращения и удаляются в виде конечных продуктов обмена. По своим основным параметрам сеть биохимических реакций находится в стационарном состоянии. Для каждого вещества процессы поступления его в систему, превращения в ней и удаления в виде продуктов обмена взаимно скомпенсированы, в результате чего концентрации веществ и скорости превращений поддерживаются на постоянном уровне. Это обеспечивается системами регулирования путем взаимного согласования всех констант скоростей химических реакций и констант переноса веществ через
116
клеточные мембраны. При изменении внешних условий сеть биохимических реакций переходит с одного стационарного уровня на другой, что обеспечивается системами регулирования путем изменения кинетических параметров системы.
Эволюция стационарного состояния происходила в направлении изыскания процессов, протекающих с более высокой скоростью, но при сохранении их устойчивости. Именно более высокие скорости процессов отличают высшие организмы от низших. Более высокие скорости процессов позволяют быстрее и лучше адаптироваться к внешней среде и тем самым более успешно вести борьбу за существование. Повышение скорости реакций в процессе эволюции происходило с помощью ферментов. Но чем выше скорости процессов в системе, тем менее устойчивой и надежной является данная система. Устойчивость и надежность организмов обеспечивалась развитием в процессе эволюции систем саморегуляции с обратной связью, поддерживающих гомеостаз. В результате противоречия между скоростью реакций и надежностью систем возникло такое интересное явление: отдельные клетки высших организмов являются менее устойчивыми по отношению к изменению условий среды, чем отдельные клетки низших животных. В то же время высшие организмы в целом устойчивее, чем низшие, к изменению внешних условий, что обусловлено более совершенной системой саморегуляции на уровне целого организма у высших животных.






