Если молекула вещества находится в невозбужденном состоянии, то электроны расположены на самом нижнем энергетическом уровне. Электронная оболочка молекулы находится при этом в синглетном состоянии, т. е. таком состоянии, когда все электроны спарены и суммарный спиновый момент равен нулю. Это состояние называется основным синглетным состоянием, а уровень, на котором в это время находятся электроны, называется основным энергетическим уровнем. Обозначим его S 0 (рис. 12). Рассмотрим электронные переходы в молекулах на примере электронных переходов в молекуле тирозина. Если молекулы поглощают кванты света, то электроны внешних оболочек молекул переходят на более высокий энергетический уровень S2*(пе-
79
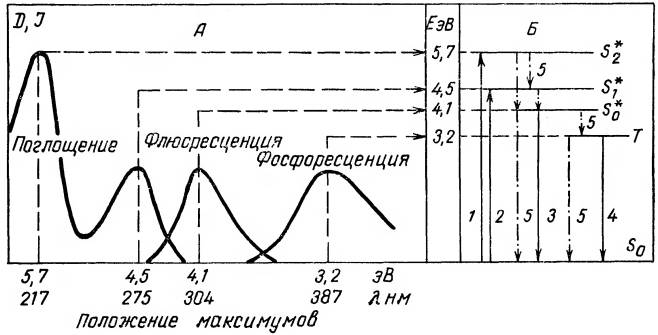 |
Рис. 12. Схема электронных энергетических уровней молекулы тирозина (Б), полученная на основании изучения спектров поглощения и излучения (А) тирозина (по Ю. А. Владимирову, 1965).
реход 1 на рис. 12). При этом электронные оболочки остаются в синглетном состоянии, хотя молекула становится возбужденной. Величина энергии поглощенного кванта равна разности двух энергетических уровней между которыми осуществляется переход электрона:
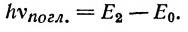 (8)
(8)
где ν погл. — частота поглощаемого света, Е2 и Е0 — энергия уровней, между которыми осуществляется переход. Таким образом, переход электрона с основного синглетного уровня на возбужденный синглетный уровень будет соответствовать поглощению света, которое кратко записывается: Sо:—>S*.
Если молекула может поглощать свет другой длины волны, то электрон перейдет уже не на уровень S2*, а на другой уровень, соответствующий энергии поглощаемого кванта. Если энергия этого кванта будет меньше, то энергетический уровень будет расположен ниже S2* (на рис. 12 это уровень S1* и переход 2). Таких возбужденных синглетных уровней молекула может иметь несколько. Каждому из них на спектре поглощения будет соответствовать свой максимум оптической плотности. На рис. 12 показаны только электронные уровни молекулы и не показаны колебательные и вращательные подуровни. Если бы молекулы обладали только электронными уровнями, то количество энергетических
80
переходов было бы ограничено и молекулярные спектры имели бы линейчатый характер, а вещества обладали бы высокой избирательностью поглощения. В действительности из-за расщепления электронных уровней на колебательные и вращательные подуровни количество энергетических переходов молекул значительно возрастает и молекулярные спектры являются сплошными. При этом наиболее вероятным электронным переходам в спектре поглощения соответствуют максимумы. Кроме этого, большое значение в возникновении сплошных спектров молекул имеет взаимодействие молекул с растворителем, характер которого различен для разных молекул.
В возбужденном состоянии молекулы долго находиться не могут; обычно продолжительность периода, пока молекула находится в возбужденном состоянии, не превышает 10-8 с. Электронная энергия возбужденной молекулы может расходоваться в результате протекания нескольких процессов: может передаваться другой молекуле — миграция энергии; может быть использована для увеличения колебательной (тепловой) энергии молекулы. Во всех этих случаях электрон либо возвращается на основной энергетический уровень Sо, либо переходит на какой-либо уровень, лежащий ниже данного возбужденного уровня. Штрих-пунктирные стрелки 5 на рис. 12 изображают электронные безизлучательные переходы, сопровождающиеся растратой энергии в тепло.
Кроме вышеназванных процессов, может происходить свечение молекул, сопровождающее их переход в невозбужденное состояние. Электроны при этом возвращаются на основной энергетический уровень. Процесс свечения молекул, сопровождающий переход электронов с возбужденных уровней на основной, называется люминесценцией. Люминесценция делится на два вида: флюоресценцию и фосфоресценцию (послесвечение).
Переход электронов с возбужденных уровней на основной всегда начинается с перехода электронов с верхних возбужденных уровней на самый нижний возбужденный уровень.
Это переходы S2* —> S1* S1*—>S0*, S2*—>S0*. Кванты при этом не высвечиваются и электронная энергия молекулы переходит в тепло. Этот процесс растраты энергии происходит очень быстро — за
5 Медицинская биофизика
81
10-13—10-12 с. Следующий этап перехода электронов заключается в переходе с нижнего возбужденного уровня S0* на основной уровень S0. При этом будет высвечиваться квант люминесценции. Так как часть запасенной при поглощении света энергии растратилась в тепло, то энергия кванта люминесценции всегда будет меньше энергии поглощенного кванта. Она будет меньше на величину растраченной в тепло энергии Етепл:
 где ν люм — частота света, испускаемого при люминесценции. Следовательно, излучаемый свет будет иметь меньшую частоту и большую длину волны, чем поглощаемый свет. Эта зависимость носит название закона Стокса: длина волны света, испускаемого при люминесценции, всегда больше длины волны света, который ее вызвал: λлюм > λ погл. Данная закономерность является отражением второго закона термодинамики, согласно которому переход энергии из одной формы в другую сопровождается рассеиванием энергии в тепло.
где ν люм — частота света, испускаемого при люминесценции. Следовательно, излучаемый свет будет иметь меньшую частоту и большую длину волны, чем поглощаемый свет. Эта зависимость носит название закона Стокса: длина волны света, испускаемого при люминесценции, всегда больше длины волны света, который ее вызвал: λлюм > λ погл. Данная закономерность является отражением второго закона термодинамики, согласно которому переход энергии из одной формы в другую сопровождается рассеиванием энергии в тепло.
Интенсивность люминесценции оценивается c помощью специального понятия — квантового выхода. Под квантовым выходом люминесценции <φ понимается отношение количества квантов люминесценции п к количеству поглощенных квантов N:
 (10)
(10)
Так как люминесценция всегда наблюдается при переходе электронов с нижнего возбужденного уровня на основной, то интенсивность люминесценции не будет зависеть от того, на какой уровень перед этим был заброшен электрон при поглощении кванта. Это положение носит название закона Вавилова: квантовый выход (вероятность) люминесценции не зависит от длины волны света, вызвавшего люминесценцию.
Люминесценция, которая наблюдается при переходе электрона с нижнего возбужденного синглетного уровня на основной S 0*—> S 0, называется флюоресценцией. Так как длительность жизни молекул в возбужденном состоянии составляет 10-9—10-8 с, то флюоресценция наблюдается только непосредственно во время освещения объекта. Однако давно обнаружено, что многие вещества (особенно при низкой температуре) продолжа-
82
ют интенсивно светиться даже после выключения света. Это свечение обусловлено переходом электронов с так называемого триплетного уровня. Выше уже говорилось о триплетном состоянии электронных оболочек, при котором имеются два неспаренных электрона. Триплетный уровень (Т на рис. 12) расположен несколько ниже нижнего синглетного возбужденного уровня S 0*. Триплетный уровень является запрещенным — сюда электрон не может попасть с основного уровня (переходы S 0— T маловероятны). На триплетный уровень электрон может попасть с возбужденного синглетного уровня; тогда весь его путь будет S 0—>S*— >Т. Электрон часть энергии расходует в тепло и переходит с нижнего возбужденного синглетного уровня на триплетный. При этом переходе спин электрона меняется на противоположный, в результате чего два электрона становятся неспаренными, а молекула превращается в бирадикал.
Продолжительность жизни молекулы в триплетном состоянии составляет от 10-3 с до нескольких секунд. Так как в триплетном состоянии молекула имеет два неспаренных электрона, то она обладает высокой химической активностью и может вступать в химическое взаимодействие. Кроме того, электрон может переходить с триплетного уровня на основной и освобождаемая при этом энергия или рассеивается в тепло, или высвечивается в виде кванта люминесценции. Люминесценция, которая сопровождает переход электронов с триплетного уровня на основной Т —> S 0 (переход 4 на рис. 12), называется фосфоресценцией. Так как триплетный уровень находится ниже синглетного возбужденного уровня, то длина волны света, испускаемого при фосфоресценции, еще больше, чем испускаемого при флюоресценции.
Если по одной оси отложить длину волны излучаемого при люминесценции света, а по другой оси — интенсивность люминесценции, то получим кривую спектра люминесценции. Спектры люминесценции делятся на спектры флюоресценции и спектры фосфоресценции. На рис. 12, А изображены спектры поглощения и люминесценции тирозина. Уровень S 0 — основной синглетный уровень молекулы тирозина — условно обладает энергией, равной нулю. Тогда переход электрона S 0— S 2* при поглощении света требует энергии 5,7 эВ (электрон-вольт). Этому переходу будет соответствовать макси-
6* 83
мум в спектре поглощения на длине волны 217 нм. Другому электронному переходу при поглощении кванта S 0—> S 1* соответствует запасание энергии 4,5 эВ и в спектре поглощения соответствует максимум при λ = = 275 нм. Флюоресценция происходит, когда электрон возвращается с нижнего возбужденного синглетного уровня на основной. При этом выделяющийся квант обладает энергией 4,1 эВ. Эта энергия меньше энергии поглощенных квантов (5,7 и 4,5 эВ). Данному переходу соответствует максимум в спектре флюоресценции при λ = 304 нм. Так как длина волны света, испускаемого при флюоресценции, больше длины волны поглощенного света, то спектр флюоресценции смещен вправо по шкале длин волн относительно спектра поглощения. Фосфоресценции соответствует переход Т —> S 0. При этом излучается квант с энергией 3,2 эВ. Данному переходу в спектре фосфоресценции соответствует максимум при λ = 387 нм. Спектр фосфоресценции смещен еще правее по шкале длин волн, чем спектр флюоресценции.
Спектры люминесценции, как и спектры поглощения, получают с помощью спектрофотометров. Эти спектрофотометры имеют несколько иную конструкцию, чем рассмотренные выше. В частности, они содержат ряд светофильтров.
На основании данных о люминесценции можно судить о величине квантов энергии, запасаемой в молекуле. Наряду с данными о квантах поглощаемой энергии это позволяет рассчитывать расположение энергетических уровней молекулы. На основании люминесцентного метода можно судить о времени жизни молекул в возбужденном состоянии — по скорости возникновения и исчезновения люминесценции. Исходя из интенсивности люминесценции, можно делать заключения о процессах растраты энергии молекулой. Наконец, с помощью люминесцентного метода очень удобно исследовать состояние вещества; даже его незначительное изменение (агрегация, комплексообразование, изменение рН и т. д.) сказывается на люминесцентных свойствах.






