Организм представляет собой открытую систему, которая постоянно обменивается с окружающей средой веществом и энергией. Вещества, поступающие в организм, вступают в сложную сеть химических превращений. Скорость химических превращений в клетках и тканях организма играет основную роль в регулировании жизненного процесса. В связи с этим важное значение приобретает изучение закономерностей протекания в организме химических реакций. Кинетика изучает закономерности протекания во времени химических процессов. В отличие от биохимии, описывающей конкретные химические реакции в организме, кинетика изучает механизмы химических превращений в зависимости от различных факторов (температуры, концентрации реагирующих веществ, давления, рН, наличия катализаторов и пр.).
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ. СКОРОСТЬ РЕАКЦИИ
Каждая химическая реакция складывается из огромного количества элементарных актов, представленных превращением наименьших частиц вещества: молекул, атомов или ионов. В зависимости от количества частиц, участвующих в элементарном акте реакции, их делят на мономолекулярные, бимолекулярные и тримолекулярные реакции. Вероятность столкновения более чем трех частиц одновременно чрезвычайно мала, поэтому реакции с участием более трех частиц протекают в несколько моно-, би- или тримолекулярных стадий. В живых организмах наиболее распространенными являются моно- и бимолекулярные реакции.
95
Важнейшей количественной характеристикой химической реакции является скорость. Под скоростью реакции понимают возрастание или убывание концентрации реагирующего вещества во времени. Если вещество А превращается в вещество В:
А — > В,
то скорость реакции v — первая производная от концентрации любого из веществ по времени:
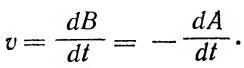 |
(1)
Скорость химической реакции зависит в основном от трех факторов: концентрации реагирующих веществ, температуры и наличия катализаторов. Согласно кинетической теории реакций, их скорость определяется количеством столкновений молекул друг с другом в единицу времени. Количество столкновений молекул зависит от количества реагирующих молекул в единице объема, т. е. от концентрации реагирующих веществ (и, следовательно, от объема и давления в случае газов). Эта зависимость открыта Гульдбергом и Вааге в 1867 г. и носит название закона действующих масс.
Если скорость реакции зависит от концентрации одного вещества, то такая реакция называется реакцией первого порядка. В случае приведенной мономолекулярной реакции А — >В по закону действующих масс
 |
(2)
где к — коэффициент, называемый константой скорости
 реакции. Если A = 1, то
реакции. Если A = 1, то
т. е. константа скорости — это скорость реакции при концентрациях реагирующих веществ, равных единице.
Так как концентрация А уменьшается со временем, то будет уменьшаться и скорость реакции. Интегрируя уравнение (2) и производя преобразования, получим:
 |
(3)
где А 0— начальная концентрация вещества A; t — время от начала реакции; е — основание натуральных лога-
96
рифмов. Из уравнения (3) следует, что скорость изолированной реакции первого порядка уменьшается во времени по экспоненциальному закону.
Если скорость реакции зависит от концентрации двух веществ, то это реакция второго порядка. Например, при реакции А+В — >С
 (4)
(4)
Порядок и молекулярность реакции не всегда совпадают. Так, бимолекулярная реакция может быть реакцией первого порядка, если одно из реагирующих веществ находится в избытке и его концентрация заметным образом не меняется. Например, гидролиз СН3СООК может определяться только концентрацией СН3СООК, если вода находится в избытке. Мономолекулярная реакция может быть реакцией нулевого порядка, когда скорость реакции не зависит от концентрации реагирующего вещества. Обычно так протекают реакции с участием ферментов в условиях избытка реагирующего вещества. В условиях нулевого порядка скорость постоянна и определяется скоростью распада фермент-субстратного комплекса. В процессе реакции может наступить переход от реакции первого порядка к реакции нулевого порядка. Если процесс протекает в клетке, куда реагирующие вещества поступают через клеточные оболочки, то в начальный момент, когда концентрация реагирующего вещества небольшая, реакция может протекать по типу реакций первого порядка, а при насыщении всех молекул фермента переходит на нулевой порядок.






