 Как уже отмечалось, скорость химических реакций пропорциональна количеству столкновений частиц друг с другом в единицу времени. Раньше полагали, что каждое столкновение реагирующих частиц приводит к химическому взаимодействию. Тогда, если количество столкновений частиц в единицу времени равно Z, а концентрации реагирующих веществ равны единице, то
Как уже отмечалось, скорость химических реакций пропорциональна количеству столкновений частиц друг с другом в единицу времени. Раньше полагали, что каждое столкновение реагирующих частиц приводит к химическому взаимодействию. Тогда, если количество столкновений частиц в единицу времени равно Z, а концентрации реагирующих веществ равны единице, то
(5)
где k — константа скорости реакции.
Медицинская биофизика 97
Однако впоследствии расчеты показали, что если бы каждое соударение приводило к реакции, то скорости реакций были бы в 102—106 раз выше реально существующих. Отсюда возникло представление, что лишь часть соударений приводит к осуществлению реакции. Для того чтобы при столкновении произошла реакция, необходимо, чтобы сталкивающиеся молекулы обладали некоторым запасом кинетической энергии, не ниже некоторого уровня Еа, называемого энергией активации.
Молекулы обладают потенциальной и кинетической энергией. Потенциальная энергия представляет собой энергию движущихся по орбитам электронов. Эту энергию можно считать электронной или химической, поскольку она выделяется при химических реакциях. Помимо этого, молекулы обладают кинетической энергией теплового хаотического движения, складывающейся из энергии поступательного, колебательного и вращательного движений.
Из квантовой физики известно, что самопроизвольная химическая реакция связана с понижением уровня потенциальной энергии реагирующих молекул. Если по оси абсцисс отложить время, которое будет характеризовать фазы каждого элементарного акта реакции, или расстояние между реагирующими молекулами — координату реакции, а по оси ординат — потенциальную энергию молекул, то уровень Е2 будет соответствовать энергии исходных продуктов реакции, а более низкий уровень Е 1— энергии конечных продуктов (рис. 13). В процессе акта реакции электроны реагирующих частиц переходят на более низкий энергетический уровень, в результате чего потенциальная энергия частиц понижается. Однако при сближении реагирующих частиц их потенциальная энергия уменьшается не сразу. Для того чтобы произошла реакция, чтобы произошло образование общих электронных пар реагирующих частиц, их потенциальная энергия должна вначале возрасти, т.е. реагирующие частицы вначале должны получить энергию. Это связано с тем, что вначале при сближении частиц их одноименно заряженные электронные оболочки испытывают отталкивание. На преодоление этого отталкивания необходима затрата энергии. Энергия, необходимая для преодоления сил отталкивания электронных оболочек при сближении реагирующих частиц, и будет энергией активации. Энергия активации представляет энергетический барьер для
98
 |
Рис. ИЗ. Схема изменения потенциальной энергии молекул в процессе
химической реакции.
Еа— энергия активации прямой реакции; E a-—энергия активации обратной реакции; Е x— энергия, выделяющаяся (поглощающаяся) при реакции.
частиц, вступающих в реакцию. Обычно активация молекул происходит за счет кинетической энергии их поступательного, колебательного и вращательного движений, но может быть вызвана и поглощением квантов лучистой энергии, что бывает при фотохимических реакциях.
После того как реагирующие частицы достаточно сблизились, их электронные облака достаточно деформировались и перекрылись, происходит образование общих электронных пар — химической связи. На этом втором этапе акта химического превращения потенциальная энергия реагирующих частиц уже понижается и происходит выделение избыточной энергии. Как следует из рис. 13, выделяющаяся при этом энергия суммируется из энергии активации и энергии химической реакции, определяемой разностью энергетических уровней исходных и конечных продуктов реакции.
Сближенное состояние реагирующих частиц, когда они обладают максимумом потенциальной энергии, называется активированным комплексом. Активированный комплекс образуется при каждом акте химического превращения и представляет собой промежуточное состояние между исходными и конечными продуктами реакции. При распаде активированного комплекса образуются продукты реакции.
7* 99
Так, реакция замещения типа АВ+С —> АС+В протекает с образованием активированного комплекса по схеме:
 |
В ходе такой реакции происходит перераспределение энергии. Активированный комплекс образуется в результате поглощения энергии активации +Е 1, а распад его сопровождается выделением энергии — Е2 , суммирующейся из ранее поглощенной энергии активации и выделяющейся энергии химической реакции, обусловленной понижением энергетического уровня валентных электронов.
Таким образом, чтобы молекулы могли вступить в реакцию, они должны обладать определенным запасом кинетической энергии. Химическая реакция происходит только в том случае, если молекулы за счет своей кинетической энергии сумеют преодолеть энергетический барьер отталкивания электронных облаков. Поэтому не всякое столкновение реагирующих частиц приводит к химической реакции. К реакции приводит лишь столкновение частиц, обладающих кинетической энергией, которая не меньше энергии активации. Чтобы отразить данное положение математически, необходимо определить долю активированных молекул в их общем количестве и подставить ее в уравнение (5).
Не все реагирующие молекулы обладают одинаковой кинетической энергией. Молекулы находятся в беспрестанном хаотическом движении и испытывают столкновения друг с другом, которые имеют случайный характер. В результате этого одни молекулы приобретают более высокую скорость движения, другие — менее высокую. При установлении равновесия в системе имеется устойчивое, независимое от времени распределение молекул по скоростям, а следовательно, и по энергиям. Это распределение описывается кривой Максвелла — Больцмана: отношение количества молекул п, обладающих энергией Е, к общему количеству молекул N равно

(6)
100
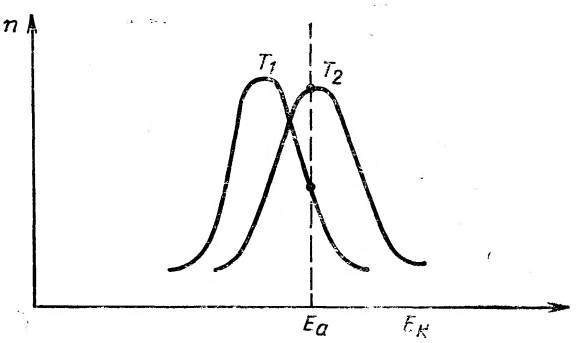 |
Рис. 14. Распределение молекул по энергиям гари двух температурах
(Т 1меньше, чем Т2).
По оси абсцисс отложена кинетическая энергия Е k молекул; по оси ординат — количество молекул п, обладающих данной энергией; Е a — энергия активации.
где R — газовая постоянная; Т — абсолютная температура; е — основание натуральных логарифмов. Отношение п/N представляет собой вероятность того, что данная молекула обладает энергией Е. На рис. 14 зависимость (6) изображена графически.
 Вероятность того, что молекула обладает энергией активации Еа, будет равна:
Вероятность того, что молекула обладает энергией активации Еа, будет равна:
 Чтобы учесть, что к реакции приводит лишь столкновение активированных молекул, необходимо эту вероятность подставить в уравнение (5):
Чтобы учесть, что к реакции приводит лишь столкновение активированных молекул, необходимо эту вероятность подставить в уравнение (5):
(8)
Рис. 13 и 14 и уравнение (8) показывают, что чем больше энергия активации (энергетический барьер), тем ниже значение константы скорости химической реакции. Однако, как показали исследования, не все столкновения даже активированных молекул приводят к реакции. Это связано с геометрической конфигурацией молекул. Реакция осуществляется лишь тогда, когда молекулы сталкиваются своими активными центрами, которые представляют собой такие участки молекул, где происходит разрыв старых связей и образование новых. Эти участки занимают лишь некоторую часть общей поверх-
101
ности молекулы, и чем больше размер молекулы, тем меньшая доля всей поверхности будет приходиться на площадь активных центров. Для характеристики эффективности столкновений молекул вводится понятие стерического фактора. Стерический фактор р представляет собой вероятность столкновения молекул активными центрами. Для крупных молекул, например белка, р имеет небольшое значение (до 10-5). Подставляя стерический фактор в уравнение (8), получим конечное уравнение, связывающее константу скорости, количество столкновений молекул, энергию активации и температуру:
 |
(9)
Уравнение (9) называется уравнением Аррениуса, который впервые изложил эти положения в 1889 г.
Реакция может протекать как в прямом, так и в обратном направлении. Однако для преодоления энергетического барьера конечные продукты должны обладать более высоким значением кинетической энергии по сравнению с исходными продуктами. Энергия активации обратной реакции будет больше энергии активации прямой реакции на величину энергии химической реакции (рис. 13). В связи с этим обратная реакция идет при поглощении энергии из окружающей среды. Ее константа
скорости k будет меньше константы скорости прямой реакции и определится из уравнения:
 (10)
(10)
где Ех — энергия химической реакции.
Но в процессе реакции за счет повышения концентрации конечных продуктов скорость обратной реакции может сравняться со скоростью прямой реакции, что приведет к установлению химического равновесия.
Из уравнения Аррениуса следует, что скорость реакции зависит от температуры. При повышении температуры константа скорости реакции увеличивается. Это объясняется увеличением энергии реагирующих молекул. Как указывалось в главе 2, средняя кинетическая энергия молекул линейно связана с абсолютной температурой. При повышении температуры энергия молекул уве-
102
 |
Рис. 15. Диаграмма Аррениуса для определения энергии активации
биологической реакции.
По оси абсцисс — обратная температура 1/ Т; по оси ординат — логарифм
скорости реакции ln k.
личивается (кривая распределения сдвигается вправо по оси энергий) и число молекул, обладающих энергией активации, увеличивается.
Удовлетворительное совпадение с законом Аррениуса было найдено для реакций гемолиза эритроцитов аммиаком и гемолитическими ядами, для реакций денатурации гемоглобина при нагревании, реакции изменения ритма сердца у холоднокровных, люминесценции у бактерий и т.д.
Изучение температурных зависимостей биологических реакций имеет большое значение. Из температурной зависимости константы скорости можно найти энергию активации этой реакции. Если прологарифмируем уравнение Аррениуса по основанию е, то получим:
 |
(11)
Между ln k и 1/ T имеется линейная зависимость, которая представлена на рис. 15. По углу наклона прямой можно экспериментально найти величину энергии активации:
 (12)
(12)
где φ —угол наклона прямой ln k —1/ T к оси абсцисс. Прямая ln k —1/ T может иметь перелом. Это будет свидетельствовать о том, что данный биологический процесс определяется какими-то двумя реакциями с разной энергией активации. При этом в одном интервале температур определяющей является одна реакция, а в ином интервале — другая.
103
В условиях целостного организма изменение температуры может влиять на скорость реакций как непосредственно, так и косвенным образом. Так, понижение температуры организма, как и в любой неживой системе, замедляет химические реакции. На этом основано применение гипотермии в медицине. Но вместе с тем оно может ввести в действие механизмы терморегуляции, ускоряющие реакции.
В отличие от реакций, протекающих в неживых системах, большинство биологических процессов имеют температурный оптимум — интервал температур, в котором реакция протекает с максимальной скоростью. Это объясняется ферментативным характером большинства биологических процессов. В случае ферментативной реакции одновременно действуют два различных фактора, определяющих влияние температуры: с одной стороны, увеличение скорости самой реакции; с другой — повышение скорости деструкции фермента при нагревании, что обусловливает непрерывное уменьшение концентрации активного фермента. Оптимальная температура зависит от соотношения между влиянием температуры на скорость самой ферментативной реакции и ее влиянием на скорость инактивации фермента.
 Влияние температуры на скорость биологических процессов часто оценивают с помощью температурного ко эффициента Q10 Вант-Гоффа. Он показывает, во сколько раз ускоряется процесс при повышении температуры на 10 °С:
Влияние температуры на скорость биологических процессов часто оценивают с помощью температурного ко эффициента Q10 Вант-Гоффа. Он показывает, во сколько раз ускоряется процесс при повышении температуры на 10 °С:
(13)
где v T— скорость процесса или величина какого-либо физико-химического показателя процесса при температуре Т; v T+10 — то же самое при температуре T+10°.
Температурный коэффициент зависит от природы протекающих реакций. Для физических процессов он немногим отличается от единицы: диффузия — 1,1 — 1,2; электропроводность — 1,2 — 1,3. Для ферментативных реакций Q10 имеет величину около 1,7, а для химических процессов — 2 — 4.
Живые организмы не всегда выдерживают изменение температуры на 10 °С. Поэтому для определения температурного коэффициента берут меньший температурный
104
интервал и пересчитывают полученные результаты
на 10 °С.
По величине температурного коэффициента биологического процесса можно судить о природе протекающих реакций, а также о разделении процесса на стадии и о механизме этих стадий. Так, А. Ф. Самойлов установил, что (процесс возбуждения в нерве имеет Q10 = 1,7,что характерно для ферментативных реакций. Для проведения же возбуждения от концевых пластинок нерва к мышце получен коэффициент 2,5—2,7, характерный для химических процессов.
Зная температурный коэффициент, можно определить энергию активации реакции, которая связана с ним соотношением:
 (14)
(14)
1
Из уравнения (14) следует, что энергия активации и логарифм температурного коэффициента связаны линейной зависимостью. Следовательно, реакции, имеющие более высокую энергию активации, будут иметь более выраженную температурную зависимость.
Энергии активации большинства биологических процессов — того же порядка, что и для химических реакций. Они группируются в основном у трех величин: 8, 12, 18 ккал/моль. Энергии активации процессов разрушения структур различными токсическими факторами очень велики — порядка 150 ккал/моль, что способствует устойчивости клеток к повреждающим воздействиям.






