В нормальных условиях между ферментом и субстратом устанавливается химическая связь — образуется активированный комплекс — фермент-субстратный комплекс. Под действием фермента конфигурация электронного облака реагирующей молекулы изменяется так, что облегчается ее вступление в реакцию. Энергия активации реакции при этом понижается. Катализаторы, в том числе и ферменты, не способны вызвать реакции, невозможные по термодинамическим условиям. Они только ускоряют обычно медленно идущие реакции в результате понижения энергии активации, необходимой для осуществления данной реакции (рис. 16).
105
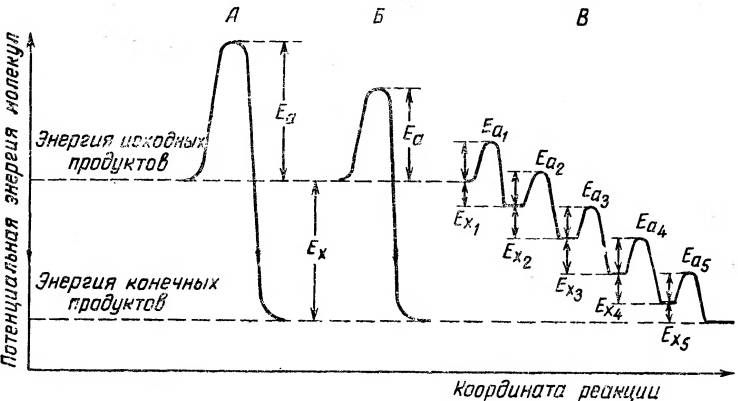 |
Рис. 16. Энергия активации неферметативной (A), ферментативной одноступенчатой (Б)и ферментативной многоступенчатой (В)реакций. Еа— энергия активации; Ех — энергия, выделяющаяся при реакции.
В 1949 г. Чанc показал, что большинство ферментативных реакций представляет собой многоступенчатый процесс. Весь суммарный ферментативный процесс разбивается на ряд составляющих его стадий, каждая из которых характеризуется относительно небольшой энергией активации, поэтому многоступенчатый катализ обладает существенными преимуществами по сравнению с одноступенчатым (рис. 16, B).
При действии ферментов благодаря уменьшению энергии активации увеличивается количество активированных молекул, что приводит к ускорению реакции. Например, реакция разложения перекиси водорода на воду и кислород
2Н202 —>2Н20 + 02
при отсутствии катализатора имеет энергию активации 18 ккал/моль. При действии фермента каталазы энергия активации снижается до 5,5 ккал/моль. Интересно, что под влиянием ферментов энергия активации реакций снижается значительно больше, чем при действии неорганических катализаторов. Например, энергия активации гидролиза сахарозы при действии кислот равна 25,6 ккал/моль, а при действии амилазы — 11 ккал/моль. Ферментативные реакции подчиняются общим закономерностям кинетики химических реакций.
106
Зависимость скорости v ферментативной реакции от концентрации С субстрата выражается уравнением Михаэлиса — Ментен:
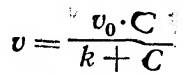 (15)
(15)
где v 0 — максимальная скорость реакции в условиях насыщения фермента; k — константа. Из уравнения (15) следует, что при повышении концентрации субстрата скорость реакции возрастает и приближается к некоторому постоянному значению, характерному дляполного связывания фермента субстратом.
Помимо зависимости от концентрации субстрата, имеется зависимость скорости ферментативного катализа от ряда других факторов: наличия ингибиторов или активаторов ферментов, наличия ионов металлов, рН среды, давления, температуры и пр. Поэтому в биологических системах скорости реакций могут меняться в очень широких пределах.
Как и все белки, ферменты представляют собой поливалентные ионы (см. главу 8), и их суммарный заряд зависит от величины рН. Вследствие этого и активность ферментов весьма сильно зависит от рН, причем для разных ферментов значения рН, при которых эта активность оказывается максимальной, могут быть различными. Зависимость активности фермента от рН обусловлена рядом факторов: диссоциацией тех боковых цепей в молекуле фермента, которые непосредственно взаимодействуют с субстратом в процессе катализа, диссоциацией субстрата, и, наконец, влиянием рН на общую конформацию молекулы фермента.
Благодаря наличию ферментов, в клетках протекают такие реакции, которые в технике или вообще невозможно осуществить, или можно осуществить в жестких условиях — при высокой температуре и высоком давлении. Ферменты уменьшают энергетический барьер, который необходимо преодолеть реагирующим молекулам, и благодаря этому в организмах реакции протекают в мягких условиях – при нормальном давлении и при невысокой температуре. Поэтому исследование механизма ферментативного катализа представляет большой интерес и для бионики, открывая перспективы создания новых высокоэффективных катализаторов для химической промышленности.
107






