ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМОВ И МОЛЕКУЛ
Для выяснения природы первичных стадий фотобиологических процессов, происходящих в биологических системах при поглощении световой энергии, необходимо иметь некоторое представление о строении атомов и молекул и их энергетических уровнях, основанное на положениях квантовой механики — науки о движении микрочастиц.
Как известно, атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, вращающихся вокруг ядра. Заряд ядра определяется количеством протонов, находящихся в нем, а атомный вес ядра равен сумме количеств протонов и нейтронов. Количество электронов, вращающихся вокруг ядра, равно заряду ядра, так что атом в целом электронейтрален.
Как было впервые установлено Н. Бором, электроны вращаются вокруг ядра только по определенным (дозволенным) орбитам с радиусом, определяемым энергией атома. Термин «электронная орбита», так же как и термины «электронный слой» и «электронная оболочка», является условным. Движение электронов в атоме описывается так называемой волновой функцией, которая позволяет только с некоторой степенью вероятности определять положение электронов в атоме. В связи с этим термин «орбита» означает наиболее вероятную область локализации электронов, а вовсе не то, что электроны движутся по определенным траекториям. Вращаясь по любой из дозволенных орбит, электрон не излучает энергии, а атом находится в стабильном состоянии. Электроны, находящиеся на более удаленных от ядра орбитах, обладают большей энергией, чем электроны, находящиеся на более близких орбитах. При поглощении атомом энергии электрон переходит на более удаленную орбиту и атом переходит в возбужденное состояние. При переходе электрона с более удаленной орбиты на основную выделяется энергия в виде кванта электромагнитного излучения. Если начальная энергия атома была Е 1, а конечная — после перехо-
5* 67
да электрона с одной орбиты на другую — Е 2, то энергия ΔЕ, выделяемая или поглощаемая при переходе, будет равна:
 (1)
(1)
где h = 6,62-10~27 эрг•с; v — частота излучаемого или поглощаемого кванта.
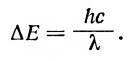 Учитывая, что частота излучения связана со скоростью света с и длиной волны λизлучения соотношением λ = с/ v, можно записать:
Учитывая, что частота излучения связана со скоростью света с и длиной волны λизлучения соотношением λ = с/ v, можно записать:
(2)
Электронная энергия атома, а также энергия излучения и поглощения имеют квантовый характер: они могут принимать не любые значения, а только определенный ряд дискретных значений, определяемых наличием дозволенных орбит электронов.
 Экспериментально
Экспериментально
__ это проявляется в том, что атом-
ные спектры излучения и погло-
щения состоят из отдельных ли-
----------------- ний, соответствующих (переходам
электронов с одного дозволенно-
го уровня на другой.
______________ Из всех возможных положений
_______________ в атоме электрон занимает
положение с минимальной энер-гией. Такое состояние электрона
________________ в атоме называется основным, а
уровень энергии, на котором
__________________ в данном случае находится элект-
____________________ рон, называется основным уров-
____________________ нем энергии.
Химические свойства элемен-
тов определяются строением их в наружном электронном слое,
определяет группу, в которой на- ходится элемент в периодической
системе. Часть электронов, нахо-
дящихся во внешнем электрон-
ном слое атомов, являются спа-
68
ренными, а часть — неспаренными (за исключением атомов инертных газов). Спаренные электроны находятся на одной орбите и имеют антипараллельные спины (рис. 8). Неспаренные электроны — это одиночные электроны на орбитах. При образовании молекул химическая связь возникает в основном благодаря взаимодействию неспаренных электронов двух атомов.
В большинстве случаев все электроны в молекуле спарены и их суммарный спиновой момент равен нулю. Такое состояние электронных оболочек называется синглетным. Если молекула или часть молекулы имеет один неспаренный электрон, то такое соединение называется монорадикалом. Примерами монорадикалов могут быть ОН (свободный гидроксил), СН3 (свободный метил) и др. Точкой обычно обозначают наличие неспаренного электрона. В некоторых случаях соединение может иметь два неспаренных электрона. Тогда оно называется бирадикалом. В этом случае суммарный спиновый момент может принимать одно из трех значений: + 1, 0, —1, и такое состояние электронной оболочки называется триплетным. Простейшим веществом, основное состояние которого бирадикально, является, например, кислород; его молекула обладает двумя неспаренными электронами: О—О.
Свободные радикалы могут быть нейтральными и заряженными; в последнем случае они называются ионрадикалами.
Кроме электронной энергии, молекулы обладают колебательной и вращательной энергией, относящейся к тепловой энергии. Колебательная энергия молекул обусловлена колебаниями отдельных атомов или групп атомов внутри молекулы. Вращательная энергия молекул обусловлена вращением молекул вокруг каких-либо осей.
Согласно представлениям классической физики, энергия колебательного и вращательного движения молекул может изменяться непрерывно. Однако, как было установлено впоследствии, колебательная и вращательная энергия молекул, так же как и электронная энергия, имеет квантовый характер, т. е. изменяется дискретно. Расстояния между колебательными уровнями энергии молекулы гораздо меньше, чем расстояния между электронными уровнями. Поэтому каждый элек-
69
 тронный уровень молекулы распадается на ряд колебательных уровней или подуровней (рис. 9). В свою очередь каждому колебательному уровню молекулы соответствует ряд вращательных подуровней, расстояние между которыми еще меньше, чем между колебательными уровнями.
тронный уровень молекулы распадается на ряд колебательных уровней или подуровней (рис. 9). В свою очередь каждому колебательному уровню молекулы соответствует ряд вращательных подуровней, расстояние между которыми еще меньше, чем между колебательными уровнями.
При поглощении и испускании энергии молекула переходит с одного энергетического уровня на другой. Переход молекул на более высокий вращательный или колебательный уровень возможен в результате поглощения молекулой квантов инфракрасного излучения, а также при возбуждении молекул термическим путем. Как и атом, молекула может поглотить фотон только в том случае, если его энергия в точности равна разности между энергетическими уровнями молекулы.
Колебательные уровни сложных молекул зависят от их конформации — пространственной структуры. При изменении конформации молекул колебательные уровни изменяют свое положение.
В соответствии с этим изменяется и спектр инфракрасного поглощения. Например, белок в
β-конформации и в α-спиральной конформации имеет разные полосы поглощения, что лежит в основе применения метода инфракрасной спектроскопии для определения конформации макромолекул.
Расстояния между электронными энергетическими уровнями значительно больше, чем между колебательными и вращательными уровнями. В соответствии с этим перевести молекулу на более высокий электронный уровень могут лишь фотоны, принадлежащие видимой или ультрафиолетовой областям спектра. Чисто электронных переходов не существует. Переходы между электронными уровнями, как правило, сопровождаются одновременным изменением колебательного и вра-
70
щательного состояний молекулы. В результате того что электронные уровни молекул распадаются на колебательные и вращательные подуровни, количество возможных энергетических переходов молекул значительно возрастает по сравнению с атомами. Это приводит к значительному усложнению молекулярных спектров поглощения и излучения, которые в отличие от атомных спектров имеют не линейчатый, а сплошной характер.






