3.1 як≥ елементи пТ€того пер≥оду пер≥одичноњ системи Ї найтипов≥шими металом ≥ неметалом? „ому?
3.2 ¬иход€чи з положенн€ Ѕар≥ю в пер≥одичн≥й систем≥ напиш≥ть формули його найвищого оксиду та г≥дроксиду ≥ њх найважлив≥ш≥ х≥м≥чн≥ властивост≥.
3.3 ¬каж≥ть, €кий з г≥дроксид≥в про€вл€Ї б≥льш сильн≥ основн≥ властивост≥: 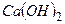 чи
чи  ,
, 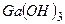 чи
чи  ? ¬≥дпов≥дь по€сн≥ть.
? ¬≥дпов≥дь по€сн≥ть.
3.4 який з метал≥в найб≥льш енерг≥йно реагуЇ з водою при нормальних умовах Ц магн≥й, кальц≥й чи бар≥й? «апиш≥ть можлив≥ р≥вн€нн€ реакц≥й. ¬исновки обірунтуйте.
3.5 ’лор ≥ ћанган знаход€тьс€ в одн≥й груп≥ пер≥одичноњ системи. „им по€снюЇтьс€ њх в≥дм≥нн≥сть в х≥м≥чних властивост€х? ¬≥дпов≥дь обірунтуйте ≥ навед≥ть в≥дпов≥дн≥ р≥вн€нн€ реакц≥й.
3.6 онф≥гурац≥€ зовн≥шн≥х електронних оболонок атом≥в 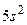 ≥
≥  . ¬ €ких групах ≥ пер≥одах знаход€тьс€ ц≥ елементи? як вони реагують з хлоридною кислотою?
. ¬ €ких групах ≥ пер≥одах знаход€тьс€ ц≥ елементи? як вони реагують з хлоридною кислотою?
3.7 –озташуйте оксиди в пор€дку зростанн€ њх кислотних властивостей:  ,
,  ,
,  ,
, 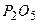 ,
,  . ¬≥дпов≥дь обірунтуйте.
. ¬≥дпов≥дь обірунтуйте.
3.8 –озташуйте елементи в пор€дку зростанн€ њх неметал≥чних властивостей: ќксиген, ‘осфор, —ульфур, —елен. ¬≥дпов≥дь обірунтуйте.
3.9 –озташуйте кислоти в пор€дку зростанн€ њх кислотних властивостей:  ,
,  ,
,  ,
,  . ¬≥дпов≥дь обірунтуйте.
. ¬≥дпов≥дь обірунтуйте.
3.10 –озташуйте г≥дроксиди в пор€дку зростанн€ њх основних властивостей: 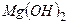 ,
, 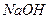 ,
,  ,
,  . ¬≥дпов≥дь обірунтуйте.
. ¬≥дпов≥дь обірунтуйте.
“ест є 1
3.1 ƒ.≤.ћенделЇЇв передбачив ≥снуванн€ ≥ детально теоретично описав властивост≥ с≥мейства елемент≥в...
3.2 ѕ≥сл€ в≥дкритт€ пер≥одичного закону в таблиц≥ ƒ.≤.ћенделЇЇва по€вились с≥мейства елемент≥в...
3.3 ≤з перерахованих нижче характеристик атом≥в елемент≥в пер≥одично зм≥нюютьс€:
1) зар€д атома;
2) в≥дносна атомна маса;
3) число енергетичних р≥вн≥в в атом≥;
4) число електрон≥в на зовн≥шньому енергетичному р≥вн≥.
3.4 ¬середин≥ пер≥оду зб≥льшенн€ протонного числа супроводжуЇтьс€:
1) зменшенн€м атомного рад≥уса ≥ зростанн€м електронегативност≥ атома;
2) зростанн€м атомного рад≥уса ≥ зменшенн€м електронегативност≥ атома;
3) зменшенн€м атомного рад≥уса ≥ зменшенн€м електронегативност≥ атома;
4) зростанн€м атомного рад≥уса ≥ зростанн€м електронегативност≥ атома.
3.5 який ≥з наведених елемент≥в названий на честь крањни:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4) 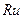 .
.
3.6 який ≥з наведених елемент≥в названий на честь континенту:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
3.7 ѕо€сн≥ть, чому:
- √≥дроген у пер≥одичн≥й систем≥ х≥м≥чних елемент≥в розм≥щують у ≤ та V≤≤ групах;
- Ќ≥троген, ‘луор не про€вл€ють валентн≥сть, що дор≥внюЇ номеру групи;
- ÷инк, на в≥дм≥ну в≥д упруму, у сполуках завжди про€вл€Ї пост≥йний ступ≥нь окисненн€;
- неметал ’лор ≥ метал ћанган розташован≥ в одн≥й груп≥ пер≥одичноњ системи х≥м≥чних елемент≥в.
3.8 Ќапиш≥ть формули вищих оксид≥в ≥ в≥дпов≥дних кислот, назв≥ть ц≥ кислоти:
| є п/п | елемент | оксид | кислота | назва кислоти |

| ||||

| ||||
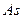
| ||||
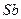
|
3.9 Ќа основ≥ розм≥щенн€ елемента в пер≥одичн≥й систем≥ напиш≥ть його сполуки, формули €ких вказан≥ нижче:
|
|
|
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
3.10 Ќа основ≥ розм≥щенн€ елемента в пер≥одичн≥й систем≥ навед≥ть формули його вищого оксиду ≥ г≥дроксиду ≥ вкаж≥ть њх характер:
| є п/п | елемент | оксид | г≥дроксид | характер |

| ||||
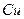
| ||||

| ||||

|
3.11 який ≥з перерахованих елемент≥в найб≥льш розповсюджений на земл≥:
1)  ; 2)
; 2)  ; 3)
; 3) 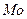 ; 4)
; 4)  .
.
3.12 який елемент найб≥льш розповсюджений в —он€чн≥й систем≥:
1) ќксиген; 2) √≥дроген; 3) √ел≥й; 4) арбон.
“ест є2
3.1 —к≥льки неспарених електрон≥в маЇ атом Ѕерил≥ю в незбудженому стан≥?
а) жодного; б) 2; в) 1.
3.2 як≥ х≥м≥чн≥ властивост≥ про€вл€Ї вищий оксид елемента з протонним числом 24?
а) основн≥; б) амфотерн≥; в) кислотн≥.
3.3 ўо Ї сп≥льного у будов≥ атом≥в елемент≥в з протонними числами 6 ≥ 9:
а) зар€д €дра; б) к≥льк≥сть електрон≥в;
в) к≥льк≥сть електронних р≥вн≥в;
г) к≥льк≥сть електрон≥в на зовн≥шньому р≥вн≥.
¬≥дпов≥дь п≥дтверд≥ть схемами будови атом≥в цих елемент≥в.
3.4 ўо Ї сп≥льного у будов≥ атом≥в з протонними числами 13 ≥ 14:
а) зар€д €дра; б) к≥льк≥сть нейтрон≥в;
в) к≥льк≥сть електронних р≥вн≥в;
г) к≥льк≥сть електрон≥в на зовн≥шньому р≥вн≥?
¬≥дпов≥дь п≥дтверд≥ть схемами будови атом≥в цих елемент≥в.
3.5 яку к≥льк≥сть неспарених електрон≥в м≥стить електронна оболонка атома з пор€дковим номером 18?
а) 1; б) 7; в) жодного.
3.6 Ќазв≥ть елемент за такими даними: знаходитьс€ у V груп≥, в≥дносна молекул€рна маса вищого оксиду 108:
а) Ќ≥троген; б) ‘осфор; в) јрсен.
“ема 4 Ћј—» Ќ≈ќ–√јЌ≤„Ќ»’ —ѕќЋ”
ѕриклад 1. яким чином утворюютьс€ назви кислих солей? (див. додаток Ѕ).
¬≥дпов≥дь: ƒо складу кислих солей, кр≥м кат≥она металу входить один або к≥лька кат≥он≥в √≥дрогену. Ќазви будуютьс€ €к ≥ дл€ середн≥х, але до назви ан≥она додають слово У√≥дрогенФ, €ке пишетьс€ разом з кислотним залишком ≥ числовими преф≥ксами.
ѕор≥вн€Їмо назви середн≥х та кислих солей:
 - кал≥й карбонат - кал≥й карбонат
|  - кал≥й г≥дрогенкарбонат - кал≥й г≥дрогенкарбонат
|
 - натр≥й ортофос фат - натр≥й ортофос фат
|  - натр≥й г≥дрогенортофосфат - натр≥й г≥дрогенортофосфат
|
 - ферум (≤≤≤) сульфат - ферум (≤≤≤) сульфат
|  - ферум (≤≤≤) г≥дрогенсульфат - ферум (≤≤≤) г≥дрогенсульфат
|
 - магн≥й сульф≥д - магн≥й сульф≥д
|  - магн≥й г≥дрогенсульф≥д - магн≥й г≥дрогенсульф≥д
|
исл≥ сол≥ називають ще г≥дрогенсол€ми.
ѕриклад 2. як≥ х≥м≥чн≥ властивост≥ характерн≥ дл€ кислих солей?
¬≥дпов≥дь: исл≥ сол≥, завд€ки на€вност≥ в њх молекулах г≥дроген-≥он≥в, про€вл€ють де€к≥ властивост≥ кислот Ц здатн≥ взаЇмод≥€ти з речовинами основного характеру з утворенн€м середн≥х солей, взаЇмод≥€ти з металами. Ќаприклад:


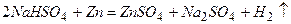
” вод≥ кисл≥ сол≥ практично повн≥стю дисоц≥юють на кат≥они металу та ан≥они кислоњ сол≥.
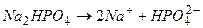
јн≥они кислоњ сол≥ до певноњ м≥ри здатн≥ дисоц≥ювати на г≥дроген кат≥они та ан≥они кислоти.
ѕриклад 3. як одержують кисл≥ сол≥?
¬≥дпов≥дь:
исл≥ сол≥ можна одержати:
1) ѕри д≥њ кислоти на середню с≥ль

2) ѕри неповн≥й нейтрал≥зац≥њ кислоти основою

ѕриклад 4. яким чином утворюють основн≥ сол≥?
¬≥дпов≥дь: ќсновн≥ сол≥ можна розгл€дати €к продукт неповного зам≥щенн€ г≥дроксид-≥он≥в багатокислотноњ основи або амфотерного г≥дроксиду на кислотн≥ залишки. ≤ншими словами, основн≥ сол≥ Ц це речовини, до складу €ких вход€ть кат≥они металу та два р≥зновиди ан≥он≥в Ц ан≥они кислоти та г≥дроксид-≥они. Ќаприклад:
|
|
|
| ќснова | —ередн€ с≥ль | ќсновна с≥ль |
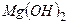
| 
| 
|

| 
| 
|
¬ молекулах однокислотних основ ( та ≥н.) Ї т≥льки один г≥дроксид-≥он, тобто його неможливо зам≥нити частково. “ому так≥ основи основних солей не утворюють.
та ≥н.) Ї т≥льки один г≥дроксид-≥он, тобто його неможливо зам≥нити частково. “ому так≥ основи основних солей не утворюють.
ƒл€ полегшенн€ написанн€ х≥м≥чних формул основних солей необх≥дно памТ€тати, що в склад≥ основноњ сол≥ г≥дроксид-≥они та кат≥они металу складають Їдине ц≥ле Ц кат≥они основноњ сол≥, валентн≥сть €кого визначають €к алгебрањчну суму валентностей кат≥ону металу та г≥дроксид-≥он≥в. Ќаприклад:
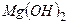
| 
| 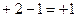
|

| 
| 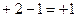
|
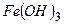
| 

| 

|
«наючи валентн≥сть кат≥ону основноњ сол≥ та кислотного залишку легко написати х≥м≥чну формулу основноњ сол≥. Ќаприклад:
| ат≥он основноњ сол≥ | ислотний залишок | ќсновна с≥ль |

| 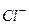
| 
|
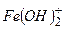
| 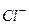
| 
|

| 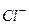
| 
|

| 
| 
|
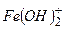
| 
| 
|

| 
| 
|
Ќазви основних солей утворюютьс€ под≥бно до назв середн≥х солей, т≥льки до назви кат≥ону металу дописують слово г≥дроксид (в≥д Уг≥дроген≥умФ Ц водень, та Уоксиген≥умФ - оксиген), €кщо до складу основноњ сол≥ входить одна група -  , та Ц диг≥дроксид, €кщо њх Ї дв≥.
, та Ц диг≥дроксид, €кщо њх Ї дв≥.
ѕор≥вн€Їмо назви середн≥х та основних солей:
 - магн≥й хлорид - магн≥й хлорид
|  - магн≥йг≥дроксо хлорид - магн≥йг≥дроксо хлорид
|
 - алюм≥н≥й н≥трат - алюм≥н≥й н≥трат
|  - алюм≥н≥йг≥дроксо н≥трат - алюм≥н≥йг≥дроксо н≥трат
 - алюм≥н≥йдиг≥дроксо н≥трат - алюм≥н≥йдиг≥дроксо н≥трат
|
 - ферум (≤≤≤) сульфат - ферум (≤≤≤) сульфат
|  - ферум (≤≤≤) г≥дроксо сульфат - ферум (≤≤≤) г≥дроксо сульфат
 - ферум (≤≤≤) диг≥дроксо сульфат - ферум (≤≤≤) диг≥дроксо сульфат
|
ќсновн≥ сол≥ називають ще г≥дроксол€ми.
ѕриклад 5. як≥ х≥м≥чн≥ властивост≥ характерн≥ дл€ основних солей?
¬≥дпов≥дь: ќсновн≥ сол≥, завд€ки на€вност≥ в њх молекулах г≥дроксид-≥он≥в, про€вл€ють де€к≥ властивост≥ основ. Ќаприклад, вони взаЇмод≥ють з речовинами кислотного характеру з утворенн€м середн≥х солей:

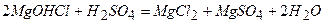
якщо г≥дроксид амфотерний, то ≥ основна с≥ль, €ка походить в≥д нього, про€вл€Ї амфотерн≥ властивост≥

ѕереважна б≥льш≥сть основних солей, €к ≥ основи, в≥д €ких вони поход€ть, нерозчинна у вод≥. –озчинена у вод≥ частина сол≥ дисоц≥юЇ на кат≥он основноњ сол≥ та кислотний залишок. Ќаприклад:

ѕодальша дисоц≥ац≥€ кат≥ону основноњ сол≥ практично не в≥дбуваЇтьс€.
ѕриклад 6. як можна одержати основн≥ сол≥?
¬≥дпов≥дь: ќсновн≥ сол≥ можна одержати:
1) ѕри д≥њ основи на середню с≥ль ц≥Їњ ж основи

2) ѕри неповн≥й нейтрал≥зац≥њ основи або амфотерного г≥дроксиду кислотою:

ѕриклад 7. яким чином складаютьс€ формули кислих ≥ основних солей?
¬≥дпов≥дь: —труктурн≥ формули кислих солей складаютьс€ таким же чином, €к ≥ структурн≥ формули середн≥х солей, тобто можна скористатись такою посл≥довн≥стю: структурна формула кислоти Ц структурна формула кислотного залишку кислоњ сол≥ Ц структурна формула кислоњ сол≥. Ќаприклад:

—труктурн≥ формули основних солей складають виход€чи ≥з структурних формул в≥дпов≥дних основ та кислот: звТ€зують рисками залишок основи (п≥сл€ в≥дщепленн€ в≥дпов≥дноњ к≥лькост≥ груп -  ) та ан≥он кислоти. Ќаприклад:
) та ан≥он кислоти. Ќаприклад:

ѕриклад 8. як≥ складн≥ сполуки називають амфотерними оксидами? Ќавед≥ть приклади.
¬≥дпов≥дь: јмфотерними називають оксиди, г≥драти €ких здатн≥ про€вл€ти €к основн≥, так ≥ кислотн≥ властивост≥.
—ам≥ амфотерн≥ оксиди, в залежност≥ в≥д того, з €кими речовинами вони взаЇмод≥ють, також здатн≥ про€вл€ти властивост≥ €к основних, так ≥ кислотних оксид≥в. ƒо амфотерних в≥днос€тьс€:
1) оксиди де€ких елемент≥в головних п≥дгруп -  ,
,  ,
,  ,
,  ,
, 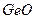 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 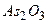 ,
,  та де€к≥ ≥нш≥;
та де€к≥ ≥нш≥;
2) оксиди де€ких метал≥в поб≥чних п≥дгруп, част≥ше так≥, в €ких метали про€вл€ють пром≥жн≥ ступен≥ окисненн€, наприклад:  ,
,  ,
,  ,
,  ,
,  .
.
¬ластивост≥ оксид≥в тих метал≥в поб≥чних груп, €к≥ здатн≥ про€вл€ти р≥зн≥ ступен≥ окисненн€, зм≥нюютьс€ в≥д основних через амфотерн≥ до кислотних з п≥двищенн€м ступен€ окисненн€. Ќаприклад:
| основн≥ | амфотерн≥ | кислотн≥ |

| 
| 
|

| 
| 
|


| 
| 
|
Ќеобх≥дно ч≥тко у€вл€ти соб≥, що амфотерн≥ оксиди не в однаков≥й м≥р≥ здатн≥ про€вл€ти основн≥ та кислотн≥ властивост≥. ƒе€к≥ з них за властивост€ми ближче до основних оксид≥в, наприклад  ,
,  , де€к≥ Ц до кислотних, наприклад
, де€к≥ Ц до кислотних, наприклад  . ” переважн≥й б≥льшост≥ амфотерних оксид≥в елементи про€вл€ють ступен≥ окисненн€ +2, +3, р≥дше вищий.
. ” переважн≥й б≥льшост≥ амфотерних оксид≥в елементи про€вл€ють ступен≥ окисненн€ +2, +3, р≥дше вищий.
|
|
|
ѕриклад 9. як≥ характерн≥ особливост≥ амфотерних г≥дроксид≥в? ƒайте визначенн€, навед≥ть приклади, по€сн≥ть х≥м≥чн≥ властивост≥.
¬≥дпов≥дь: јмфотерн≥ г≥дроксиди Ц це г≥дроксиди, утворен≥ амфотерними оксидами. Ќаприклад:  ,
,  ,
,  ,
,  . ¬они про€вл€ють двоњсту природу, тобто здатн≥ в х≥м≥чних реакц≥€х виступати €к основн≥ (з речовинами кислотного характеру), або €к кислоти (з речовинами основного характеру).
. ¬они про€вл€ють двоњсту природу, тобто здатн≥ в х≥м≥чних реакц≥€х виступати €к основн≥ (з речовинами кислотного характеру), або €к кислоти (з речовинами основного характеру).
« пор≥вн€нн€ структурних формул основ, кислот та амфотерних г≥дроксид≥в видно, що в молекулах ус≥х цих речовин Ї групи -  . Ќаприклад:
. Ќаприклад:

–≥зниц€ у властивост€х обумовлена р≥зною м≥цн≥стю звТ€зку м≥ж атомами √≥дрогену та ќксигену в груп≥ 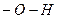 та атомом ќксигену ц≥Їњ групи з атомами елементу, €кий утворюЇ г≥драт оксиду. ¬ основах б≥льш м≥цний звТ€зок м≥ж √≥дрогеном (воднем) ≥ ќксигеном (киснем) ≥ тому при њх дисоц≥ац≥њ, а також в реакц≥€х солеутворенн€, в≥дщеплюЇтьс€ г≥дроксид-≥он
та атомом ќксигену ц≥Їњ групи з атомами елементу, €кий утворюЇ г≥драт оксиду. ¬ основах б≥льш м≥цний звТ€зок м≥ж √≥дрогеном (воднем) ≥ ќксигеном (киснем) ≥ тому при њх дисоц≥ац≥њ, а також в реакц≥€х солеутворенн€, в≥дщеплюЇтьс€ г≥дроксид-≥он 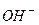 . Ќаприклад:
. Ќаприклад:

¬ кислотах м≥цн≥ший звТ€зок м≥ж атомом ќксигену та атомом кислоутворюючого елементу ≥ тому при дисоц≥ац≥њ, а також в реакц≥€х солеутворенн€, в≥дщепл€Їтьс€ г≥дроген-≥он  . Ќаприклад:
. Ќаприклад:

¬ молекулах амфотерних г≥дроксид≥в м≥цн≥сть цих звТ€зк≥в приблизно однакова, тому вони здатн≥ дисоц≥ювати €к за основним, так ≥ за кислотним типом, в залежност≥ в≥д природи речовини, з €кою вони взаЇмод≥ють. Ќаприклад:


¬ останньому р≥вн€нн≥ формула цинк г≥дроксиду записана так, €к звичайно записують формули кислот. —л≥д мати на уваз≥, що дисоц≥ац≥€ амфотерних г≥дроксид≥в у водних розчинах практично не в≥дбуваЇтьс€, тому що вони нерозчинн≥ у вод≥. “акий розрив звТ€зк≥в маЇ м≥сце в реакц≥€х солеутворенн€.
ѕриклад 10. як одержують амфотерн≥ г≥дроксиди?
¬≥дпов≥дь: јмфотерн≥ г≥дроксиди можна одержати д≥Їю луг≥в на розчини солей в≥дпов≥дних елемент≥в. Ќаприклад:


јмфотерн≥ г≥дроксиди здатн≥ взаЇмод≥€ти з лугами. ќднак, при њх одержанн≥ не сл≥д застосовувати надлишок лугу.
якщо кислотна функц≥€ амфотерного г≥дроксиду набагато сильн≥ше виражена за основу, то х≥м≥чну формулу його звичайно записують так, €к це прийн€то дл€ кислот ≥ в≥дпов≥дно утворюють назву. Ќаприклад: 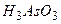 - ортоарсен≥тна кислота.
- ортоарсен≥тна кислота.
ѕриклад 11. Ќазв≥ть так≥ оксиди: 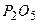 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  . Ќапиш≥ть њх структурн≥ формули та р≥вн€нн€ можливих реакц≥й з кальц≥й оксидом.
. Ќапиш≥ть њх структурн≥ формули та р≥вн€нн€ можливих реакц≥й з кальц≥й оксидом.
¬≥дпов≥дь:
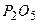 - фосфор (V) оксид.
- фосфор (V) оксид.
—труктурна формула: 
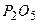 - кислотний оксид, йому в≥дпов≥дають орто- чи метафосфатна кислоти
- кислотний оксид, йому в≥дпов≥дають орто- чи метафосфатна кислоти  . –еагуЇ з кальц≥й оксидом:
. –еагуЇ з кальц≥й оксидом:
 - кальц≥й ортофосфат
- кальц≥й ортофосфат
 - кальц≥й метафосфат
- кальц≥й метафосфат
 - купрум (≤) оксид.
- купрум (≤) оксид.
—труктурна формула: 
 - основний оксид, тому з кальц≥й оксидом не реагуЇ.
- основний оксид, тому з кальц≥й оксидом не реагуЇ.
 - карбон (IV) оксид.
- карбон (IV) оксид.  - кислотний оксид, йому в≥дпов≥даЇ карбонатна кислота -
- кислотний оксид, йому в≥дпов≥даЇ карбонатна кислота -  . ¬заЇмод≥Ї з кальц≥й оксидом:
. ¬заЇмод≥Ї з кальц≥й оксидом:
 - кальц≥й карбонат.
- кальц≥й карбонат.
 - манган (V≤≤) оксид.
- манган (V≤≤) оксид.
—труктурна формула: 
 - кислотний оксид, йому в≥дпов≥даЇ перманганатна кислота -
- кислотний оксид, йому в≥дпов≥даЇ перманганатна кислота -  .
.
 - кальц≥й перманганат.
- кальц≥й перманганат.
 - стронц≥й оксид.
- стронц≥й оксид.
—труктурна формула 
 - основний оксид, тому з кальц≥й оксидом не реагуЇ.
- основний оксид, тому з кальц≥й оксидом не реагуЇ.
 - карбон (≤≤) оксид. —труктурна формула
- карбон (≤≤) оксид. —труктурна формула 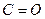 .
.
 - несолетворний оксид ≥ з кальц≥й оксидом не реагуЇ.
- несолетворний оксид ≥ з кальц≥й оксидом не реагуЇ.
 - сульфур (VI) оксид.
- сульфур (VI) оксид.
—труктурна формула: 
 - кислотний оксид, йому в≥дпов≥даЇ сульфатна кислота -
- кислотний оксид, йому в≥дпов≥даЇ сульфатна кислота -  .
.
 - кальц≥й сульфат
- кальц≥й сульфат
ѕриклад 12. як≥ з цих сполук про€вл€ють амфотерн≥ властивост≥:  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  . Ќапиш≥ть р≥вн€нн€ њх взаЇмод≥њ з кристал≥чним
. Ќапиш≥ть р≥вн€нн€ њх взаЇмод≥њ з кристал≥чним  , з розчином
, з розчином  , з розчином
, з розчином  .
.
¬≥дпов≥дь:
 - кислотний оксид, з розчином
- кислотний оксид, з розчином  не взаЇмод≥Ї.
не взаЇмод≥Ї.
 - амфотерний оксид, реагуЇ з основами ≥ кислотами. ƒл€ полегшенн€ написанн€ р≥вн€нь взаЇмод≥њ з основами сл≥д спочатку записати формулу в≥дпов≥дного г≥дроксиду:
- амфотерний оксид, реагуЇ з основами ≥ кислотами. ƒл€ полегшенн€ написанн€ р≥вн€нь взаЇмод≥њ з основами сл≥д спочатку записати формулу в≥дпов≥дного г≥дроксиду:
|
|
|

 - берил≥й оксид,
- берил≥й оксид,  - берил≥й г≥дроксид або
- берил≥й г≥дроксид або  - берилатна кислота.
- берилатна кислота.

 - натр≥й берилат.
- натр≥й берилат.
ѕри взаЇмод≥њ амфотерних оксид≥в та г≥дроксид≥в з лугами у водному середовищ≥ утворюютьс€ так зван≥ г≥дроксосол≥.
 - натр≥й тетраг≥дроксидберилат.
- натр≥й тетраг≥дроксидберилат.
¬заЇмод≥€ з  :
:

 - берил≥й сульфат.
- берил≥й сульфат.
 - метафосф≥тна кислота, з
- метафосф≥тна кислота, з  не реагуЇ.
не реагуЇ.
 - амфотерний г≥дроксид. —л≥д врахувати, що з речовинами основноњ природи амфотерного г≥дроксиду елемента з≥ ступенем окисненн€ +3 або +4, звичайно, утворюютьс€ сол≥ метакислот:
- амфотерний г≥дроксид. —л≥д врахувати, що з речовинами основноњ природи амфотерного г≥дроксиду елемента з≥ ступенем окисненн€ +3 або +4, звичайно, утворюютьс€ сол≥ метакислот:

 - метаалюм≥натна кислота
- метаалюм≥натна кислота
 - натр≥й метаалюм≥нат
- натр≥й метаалюм≥нат
 - кал≥й тетраг≥дроксоалюм≥нат
- кал≥й тетраг≥дроксоалюм≥нат

 - алюм≥н≥й сульфат.
- алюм≥н≥й сульфат.
 - несолетв≥рний оксид, в кислотно-основн≥ взаЇмод≥њ не вступаЇ.
- несолетв≥рний оксид, в кислотно-основн≥ взаЇмод≥њ не вступаЇ.
 - амфотерний оксид, реагуЇ з основами ≥ кислотами, йому в≥дпов≥даЇ г≥дроксид -
- амфотерний оксид, реагуЇ з основами ≥ кислотами, йому в≥дпов≥даЇ г≥дроксид -  .
.

 - метастанатна кислота
- метастанатна кислота

 - натр≥й метастанат
- натр≥й метастанат
 - натр≥й г≥дроксостанат
- натр≥й г≥дроксостанат

 - станум (IV) сульфат
- станум (IV) сульфат
 - основа, з лугами не взаЇмод≥Ї.
- основа, з лугами не взаЇмод≥Ї.
ѕриклад 13. —клад≥ть р≥вн€нн€ реакц≥й, схеми €ких подан≥ нижче:
Li + ЕЃ Li 2 O Li2O + ЕЃ LiNO 3 +H 2 O
Ca + ЕЃ CaO CuO + Е Ѓ CuCl 2 + H 2 O
C + Е Ѓ CO2 Li 2 O + ЕЃ LiOH
PH 3 + Е Ѓ P 2 O 5 +H 2 O P 2 O 5 + ЕЃ H 3 PO 4
Al + Е Ѓ Al 2 O 3 SO 3 + Е Ѓ Na 2 SO 4
¬≥дпов≥дь:
4 Li + O 2 = 2 Li 2 O Li 2 O + 2 HNO 3 = 2 LiNO 3 +H 2 O
2 Ca + O 2 = 2 CaO CuO + 2 HCl = CuCl 2 + H 2 O
C + O 2 = CO 2 Li 2 O + H 2 O = 2 LiOH
2 PH 3 + 4 O 2 = P 2 O 5 + 3 H 2 O P 2 O 5 + 3 H 2 O = 2 H 3 PO 4
4 Al + 3 O 2 = 2 Al 2 O 3 SO 3 + 2 NaOH = Na 2 SO 4 + H 2 O
ѕриклад 14. як≥ ≥з наведених оксид≥в реагують з водою: BaO, Li 2 O, CuO, SO 3, CaO, SiO 2, P 2 O 5, Fe 2 O 3, Al 2 O 3, Na 2 O, Mn 2 O 7? Ќапиш≥ть р≥вн€нн€ реакц≥й.
¬≥дпов≥дь: « водою взаЇмод≥ють оксиди активних метал≥в, кислотн≥ оксиди, €к≥ в≥дпов≥дають сильним ≥ середньоњ сили кислотам:
BaO + H 2 O = Ba(OH) 2 Li 2 O + H 2 O = 2 LiOH
SO 3 + H 2 O = H 2 SO 4 CaO + H 2 O =Ca(OH) 2
P 2 O 5 + 3 H 2 O =2 H 3 PO 4 Na 2 O + H 2 O = 2 NaOH
Mn 2 O 7 + H 2 O = 2 HMnO 4
ѕриклад 15. Ќапиш≥ть формули оксид≥в, г≥дратами €ких Ї наступн≥ кислоти: H 2 SO 4, H 2 SO 3, H 2 —O 3, H 2 S≥O 3, ЌћnO 4, H 3 BO 3
¬≥дпов≥дь:
H 2 SO 4 Ц SO 3 H 2 SO 3 Ц SO 2
H 2 —O 3 Ц CO 2 H 2 SiO 3 Ц SiO 2
HMnO 4 Ц Mn 2 O 7 H 3 BO 3 Ц B 2 O 3
ѕриклад 16. Ќапиш≥ть р≥вн€нн€ х≥м≥чних реакц≥й, схеми €ких дан≥ нижче:



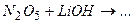
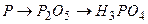

¬≥дпов≥дь:
1) 

2) 

3) 

4) 
5) 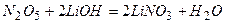
6) 
ѕриклад 17. Ќавед≥ть по три р≥вн€нн€ реакц≥й, за допомогою €ких можна отримати: а) розчинн≥ ≥ б) практично нерозчинн≥ основи. Ќазв≥ть њх.
¬≥дпов≥дь: а) –≥вн€нн€ реакц≥й добуванн€ розчинних основ:
1) 
кал≥й г≥дроксид
2) електрол≥з розчин≥в хлорид≥в активних метал≥в:

натр≥й г≥дроксид
3) реакц≥€ лужних або лужноземельних метал≥в з водою:

кальц≥й г≥дроксид
б) –≥вн€нн€ реакц≥й добуванн€ нерозчинних основ
1) обм≥нна реакц≥€ сол≥ металу ≥з лугом:

ферум (≤≤≤) г≥дроксид
2) реакц≥€ де€ких метал≥в ≥з водою:
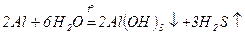
алюм≥н≥й г≥дроксид
3) повний г≥дрол≥з де€ких солей:

алюм≥н≥й г≥дроксид
ѕриклад 18. як≥ з речовин, формули €ких наведен≥, реагують з розчином натр≥й г≥дроксидом  ? Ќапиш≥ть р≥вн€нн€ практично можливих реакц≥й.
? Ќапиш≥ть р≥вн€нн€ практично можливих реакц≥й.
¬≥дпов≥дь: « розчином натр≥й г≥дроксидом реагують кислоти, кислотн≥ оксиди ≥ сол≥ (в тих випадках, коли в результат≥ реакц≥њ випадаЇ осад):





ѕриклад 19. Ќапиш≥ть р≥вн€нн€ реакц≥й, за допомогою €ких можна зд≥йснити перетворенн€:
1) 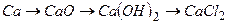
2) 
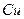

3) 


¬≥дпов≥дь:.
1) 


2) 


3) 




ѕриклад 20. якими способами отримують кислоти? —клад≥ть р≥вн€нн€ реакц≥й.
¬≥дпов≥дь:
1) исневм≥сн≥ кислоти можна отримати взаЇмод≥Їю кислотних оксид≥в з водою: 
2) Ѕезкиснев≥ кислоти отримують взаЇмод≥Їю водню ≥з неметалами:  .
.
3) —ильн≥ кислоти вит≥сн€ють б≥льш слабк≥ з солей: 
ѕриклад 21. Ќапиш≥ть по три р≥вн€нн€ реакц≥й розкладу, сполученн€, зам≥щенн€ ≥ обм≥ну, в €ких беруть участь кислоти.
¬≥дпов≥дь:
1) –озклад: 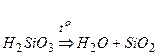


2) —полученн€: 


3) «ам≥щенн€: 


4) ќбм≥н: 

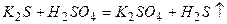
ѕриклад 22. як≥ з речовин, формули €ких наведен≥, реагують ≥з сол€ною кислотою: а)  ; б)
; б) 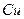 ; в)
; в)  ; г)
; г)  ; д)
; д)  .
.
¬≥дпов≥дь: « сол€ною кислотою реагують основн≥ оксиди, основи, але не реагують метали, €к≥ сто€ть в р€д≥ напруг прав≥ше водню.
а) 
б) 
в) 
г) 
д) 
ѕриклад 23. Ќапиш≥ть р≥вн€нн€ реакц≥й, €к≥ можна практично зд≥йснити:
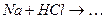









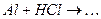


| 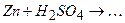









 
|
¬≥дпов≥дь:

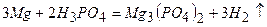






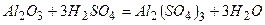




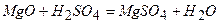






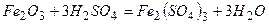


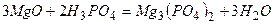

ѕриклад 24. ѕерел≥ч≥ть способи добуванн€ солей ≥ напиш≥ть по два р≥вн€нн€ в≥дпов≥дних х≥м≥чних реакц≥й.
¬≥дпов≥дь:
1) –еакц≥њ кислот ≥з металами, основними оксидами та основами:
|
|
|



2) –еакц≥њ кислотних оксид≥в ≥з основами ≥ основними оксидами:
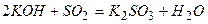

3) ќбм≥нн≥ реакц≥њ:


4) –еакц≥њ м≥ж металами ≥ неметалами:


ѕриклад 25. —клад≥ть р≥вн€нн€ реакц≥й, схеми €ких так≥:
а) 
б) 
в) 
г) 
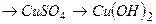
д) 
е) 
ж) 
з) 

≥) 

к) 
¬≥дпов≥дь:
а) 



б) 


в) 



г) 






д) 


е) 
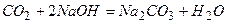


ж) 

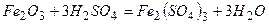
з) 




≥) 



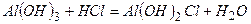
к) 


ѕриклад 26. як в≥др≥знити один в≥д одного так≥ природн≥ м≥нерали: вапн€к, г≥пс ≥ фосфорит? —клад≥ть р≥вн€нн€ реакц≥й.
¬≥дпов≥дь: ¬апн€к розчин€Їтьс€ у сол€н≥й кислот≥ ≥з вид≥ленн€м газу:
 .
.
‘осфорит розчинний в сол€н≥й кислот≥ без вид≥ленн€ газу:
 .
.
√≥пс не розчин€Їтьс€ у сол€н≥й кислот≥
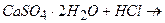 .
.
ѕриклад 27. альц≥й карбонат у вод≥ практично не розчинний. ѕроте вапн€ки вимиваютьс€ водою. „им це можна по€снити? —клад≥ть р≥вн€нн€ в≥дпов≥дних реакц≥й.
¬≥дпов≥дь: ¬ода м≥стить невелику к≥льк≥сть розчиненого карбон (≤V) оксиду, €кий реагуЇ ≥з кальц≥й карбонатом (вапн€ком) ≥ переводить його в розчинний кальц≥й г≥дрогенкарбонат:






