1.1 Скільки молекул міститься в 10 г речовини кисню?

1.2 Яка маса  молекул хлору?
молекул хлору?

1.3 Визначити відносну молекулярну масу простої речовини  , якщо маса однієї молекули
, якщо маса однієї молекули  .
.

1.4 Обчисліть масову частку Карбону в кальцій карбіді  .
.

1.5 Обчисліть густину бромоводню за воднем і за повітрям.

1.6 Під час прожарювання  масою 1 г отримано
масою 1 г отримано  масою 0,56 г і
масою 0,56 г і  об’ємом 224 мл (н. у.). Чи підтверджують ці дані закон збереження маси?
об’ємом 224 мл (н. у.). Чи підтверджують ці дані закон збереження маси?
(Підтверджують, бо маса одержаних внаслідок реакції речовин дорівнює масі речовин, яка вступила до реакції: 0,56+0,44=1)
1.7 Знайдіть масу 1 л газової суміші (у грамах з точністю до сотих), яка містить водень і азот, якщо масова частка азоту дорівнює 65 %.

1.8 Через озонатор пропустили 20 л кисню, 10% якого перетворилося на озон. Знайдіть об’ємну частку озону в кисні.

1.9 Сполука містить Натрій (масова частка 36,5%), Сульфур (25,4%) і Оксиген (38,1%). Визначте найпростішу формулу сполуки.

1.10 При певній температурі відносна густина пари фосфору за повітрям дорівнює 4,28. Скільки атомів має молекула фосфору у вигляді пари за цих умов?
(6 атомів)
1.11 Тверду речовину масою 25,4 л вмістили до посудини об’ємом 5 л, з якої попередньо викачали повітря, і підігріли до 200 ˚С. Після того, як тверда речовина перетворилась на газ, тиск у посудині дорівнює 78,6 кПа. Знайдіть молекулярну масу речовини.
(254 г/моль)
1.12 Для збільшення октанового числа в бензині додають 0,01% (за масою) тетраетилсвинцю Pb(C2H5)4. Під час згоряння бензину у газ переходить 90% свинцю. Визначте масу свинцю в грамах, з точністю до сотих, яка виділяється при згоранні 100 кг бензину?
(m(Pb) = 5,77 г)
Тема 2 БУДОВА ЯДЕР І ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ
Приклад 1. Чим відрізняються ядерні реакції від хімічних?
Відповідь: В хімічних реакціях на відміну від ядерних не відбувається зміна складу ядер і зберігається число атомів кожного елемента. Навпаки, в ядерних реакціях не виконується закон збереження маси
Приклад 2. Як поділяють атоми з однаковими і різними числами нейтронів і протонів.
Відповідь: 
Атоми з однаковим числом протонів називають ізотопами, а з однаковим числом нейтронів – ізотонами. Атоми з різним числом протонів і нейтронів, але з однаковим числом нуклонів (атомні ядра складаються з елементарних частинок протонів  р і нейтронів
р і нейтронів  n, які об’єднуються під загальною назвою нуклони) називаються ізобарами.
n, які об’єднуються під загальною назвою нуклони) називаються ізобарами.
Приклади ядер ізотопів, ізобарів та ізотонів:
| ізотопи | ізобари | ізотони |

|  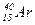
| 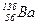
|
| (20р, 20 n) | (18р, 22 n) | (56р, 82 n) |

| 
| 
|
| (20р, 22 n) | (19р, 21 n) | (57р, 82n) |
Приклад 3. Який склад ядер ізотопів  і
і  ,
,  і
і  ?
?
Відповідь: Число протонів в ядрі дорівнює порядковому номеру елемента, яке однакове для всіх ізотопів даного елемента. Число нейтронів дорівнює різниці масового числа (вказується зліва зверху від символу елемента) і числа протонів (вказується зліва знизу від символу елемента). Різні ізотопи одного і того ж елемента мають різні числа нейтронів.
Склад вказаних ядер наступний:


Приклад 4. Атом Алюмінію був опромінений  - частинками (ядрами атомів Гелію). Напишіть рівняння ядерної реакції в повній та скороченій формах.
- частинками (ядрами атомів Гелію). Напишіть рівняння ядерної реакції в повній та скороченій формах.
Відповідь: При складанні рівнянь ядерних реакцій і реакцій радіоактивного розпаду необхідно врахувати закон збереження маси речовини (маса електрона при цьому не враховується). Крім того, заряди всіх частинок у лівій і правій частинах рівняння повинні бути однаковими.
Повна форма запису:

або

Скорочена форма:
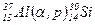
Це рівняння показує, що при взаємодії атома Алюмінію із  -частинкою утворюється атом силіцію і протон.
-частинкою утворюється атом силіцію і протон.
Приклад 5. Чим характеризується рух і стан електронів? Назвіть правила складання електронних формул.
Відповідь:
Рух електрона навколо ядра характеризується енергією та будовою атомної орбіталі (АО). Стан електрона описується значеннями 4-х квантових чисел (КЧ), а розподіл електронів на енергетичних рівнях і підрівнях зображується електронними формулами.
Квантовий стан атома з найменшою енергією електрона називається нормальним, усі інші квантові стани є збудженими.
Зміст КЧ:
Головне (n) визначає енергію орбіталі, енергетичний рівень. Можливі значення: цілі числа від 1 до ∞.
Побічне (орбітальне) – форму орбіталі, енергетичний підрівень. Можливі значення: цілі числа від 0 до n-1.
Магнітне (m l) – орієнтацію орбіталі у просторі. Можливі значення від – l до + l.
Спінове (ms) – власний магнітний момент електрона. Можливі значення: +1/2 і -1/2.






