Якщо хімічну реакцію в загальному вигляді виразити схемою А + В = C + D, то закон збереження маси можна записати в такій символічній формі:.
m(A + B) = m(C + D)
Закон збереження маси можна пояснити так: під час хімічних перетворень атоми не виникають і не можуть виникнути з нічого; загальне число атомів залишається постійним до та після реакції.
Наприклад, в реакцію Н2 + Cl2 вступає два атоми Гідрогену та два атоми Хлору і одержуються такі самі їх кількості, оскільки атоми мають постійну масу, то не змінюється і маса речовини до та після реакції.
Межі застосування:
З точки зору сучасних уявлень про зв'язок між масою та енергією закон не зовсім точний. А.Ейнштейн пропонує принцип еквівалентності, згідно з яким зміна маси речовини Δm відповідає певній кількості енергії.
E = mс2
Оскільки швидкість світла с дуже велика (с = 3 ∙ 10 8м/с), то незначні зміни маси повинні зумовлювати велике виділення енергії і навпаки. Оскільки хімічні реакції супроводжуються виділенням або поглинанням енергії, повинна змінюватися і маса реагуючих речовин. Ця зміна маси лежить за межами експериментального визначення, оскільки найсучасніші аналітичні терези можуть зафіксувати зміну маси на 1 ∙ 10-7 г..
Наприклад, зменшення маси утвореної води згідно реакції
H2 + ½ O2 = H2O + 241,8 кДж
дорівнює 2,68∙10-9 г. Таку втрату маси визначити експериментально неможливо, і нею нехтують.
Тому можна вважати, що закон збереження маси виконується під час, хімічних реакцій.
У ядерних реакціях закон не виконується: загальна маса ядер, які утворюються, менша за масу вихідних ядер на так званий дефект маси. Ядерніреакції характеризуються високими енергетичними ефектами, які досягають сотень мільйонів кілоджоулів, що відповідає зміні маси на 0,01 - 0,1 г. Наприклад, під час розпаду одного моля урану –
235 г/моль виділяється 1,939∙1010 кДж. енергії, що відповідає зміні маси на 0,215 г. Така зміна маси називається дефектом маси. За цим законом, якщо в системі виникає зміна енергії, то в цій же системі еквівалентно змінюється маса.
Використання закону:
Закон збереження маси є основою для кількісних розрахунків за хімічними рівняннями в науці та на виробництві.
Закон збереження енергії (M. В. Ломоносов)
Енергія не виникає з нічого і не зникає безслідно, вона тільки перетворюється з одного виду в інший в еквівалентних кількостях.
Закони збереження маси та енергії - це дві сторони єдиного закону природи - закону вічності матерії та її руху. Погляди Ломоносова підтверджено рівнянням А. Ейнштейна:
E = mс2
Хімічні перетворення завжди пов'язані з виділенням або поглинанням енергії..
Наприклад, сполучення металів з Сульфуром або Хлором, нейтралізація кислот лугами супроводжується виділенням значної кількості тепла. Найлегше хімічна енергія переходить у теплову, але відомі й такі, де хімічна енергія переходить у світлову (свічення фосфору та гнилого дерева на повітрі).
Хімічна енергія може перетворюватись на електричну, наприклад під час роботи акумуляторів, і навпаки в процесах пов'язаних з електролізом.
При розкладі вибухових речовин хімічна енергія перетворюється в теплову, світлову, механічну. Наприклад, розклад бертолетової солі KClO3.
Із рівняння А. Ейнштейна випливає висновок:
Якщо в системі виникає зміна енергії ∆Е, то в цій же системі еквівалентно змінюється і маса: ∆m = ∆Е/с2.
Очевидно, що в ізольованій системі енергія залишається постійною, то і маса теж повинна бути постійною при будь-яких перетвореннях всередині системи. Тому незмінність маси під час хімічних процесів спостерігається в ізольованій системі. Встановлено, що при взаємодії 1 моль НСІ з 1 моль NaOH в розведеному розчині зменшується на 56900 Дж запас енергії у вигляді виділеної теплоти в навколишнє середовище, то разом із цим повинна зменшитись маса утвореного розчину (приведеного до початкової температури) на 6,3-10-13 кг.
Стехіометричні закони
Закон сталості складу
Кожна хімічна сполука має сталий склад незалежно від способу та у мов її добування (Ж. Пруст, 1801 p.).
Наприклад, сульфур (IV) оксид можна добути задопомогою кількох хімічних реакцій:
S + O2 = SO2
Cu +2H2SO4 = CuSO4 + SO2 + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O В сульфур (IV) оксиді масова часткаСульфуру становить 50%.
Завдяки працям H. C. Курнакова було показано, що в природі є два типи сполук: із сталим та змінним складом.
Сполуки, які мають сталий склад та цілочислове атомне співвідношення компонентів, називаються дальтонідами.
Для сполук сталого складу характерний ковалентний зв'язок між атомами в тому чи іншому агрегатному стані. Наприклад: CO2, NH3, NO, НСІ, H2O, C6H6.
Сполуки змінного складу, стехіометричне співвідношення компонентів яких не відповідає цілим числам, називаються бертолідами.
Сполуки змінного складу не мають молекулярної структури. До них належить більшість твердих речовин і, зокрема, переважна більшість кристалічних сполук перехідних металів. Так, сполуками змінного складу є оксиди, гідриди, сульфіди, нітриди, карбіди та інші бінарні сполуки d- та f-елементів. Наприклад, гідриди ТіН 0,88-1,00; NbH 0,57-0,99; карбіди VC 0,56-0,88; нітриди TaN 0,6-0,9
Твердження, що кожному складу речовини відповідає тільки одна хімічна сполука, - невірне. Один і той же склад можуть мати різні речовини - ізомери.
Отже, склад хімічних сполук залежно від типу хімічного зв'язку, агрегатного етапу речовин та умов їх добування може бути як сталим, так і змінним.
Тому сучасне формулювання закону сталості складу таке: якщо хімічна сполука має молекулярну структуру, то незалежно від умов добування склад її залишається сталим. Склад хімічної сполуки, що не має молекулярної структури, може змінюватися в певних межах залежно від умов добування.
Закон еквівалентів
Із закону сталості складу можна зробити висновок, що в хімічних реакціях атоми елементів сполучаються в певних масових співвідношеннях. Англійський вчений
Дж. Дальтон вивчив ці співвідношення. Він ввів поняття про еквівалентні (рівноцінні) маси і сформулював закон еквівалентів:
Маси елементів, що реагують, відносяться між собою, як їхні еквівалентні маси:
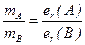
де mA і mB - маси речовин А і В;
еr(A) і er(B) – еквівалентні маси речовин А і В.
У сучасному розумінні еквівалент – це частина атома, що припадає на одиницю валентності.
Відповідно еквівалентна маса – це частина атомної маси, що припадає на одиницю валентності:
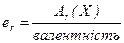 ;
;
де Аr - відносна атомна маса речовини Х.
Оскільки в хімічних сполуках між двома елементами загальне число валентностей одного елемента дорівнює загальному числу валентностей іншого елемента, а кожній одиниці валентності відповідає один еквівалент, то і число еквівалентів одного елемента дорівнює числу еквівалентів іншого елемента.
Отже, один еквівалент одного елемента реагує без залишку з одним еквівалентом іншого елемента.
Оскільки еквіваленти різних елементів реагують у співвідношенні 1:1, то співвідношення мас, які реагують без залишку, відповідають відношенню еквівалентних мас цих елементів.
Часто на практиці використовують поняття „молярна маса еквівалентів”.
Молярна маса еквівалентів – це маса речовини у грамах, що чисельно дорівнює еквівалентній масі.
Наприклад, для Карбону в СН4:
еквівалент = 1/4 атома Карбону (1/4 С),
еквівалентна маса еr 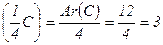 ;
;
молярна маса еквівалентів М( 1/4 С) = 3 г/моль.
Зі зміною валентності елемента змінюється його еквівалент і еквівалентна маса.
Еквівалент складної сполуки – це така частина її молекули, яка відповідає одному еквіваленту (тобто атому) Гідрогену в хімічній реакції.
Еквівалентну масу складної речовини можна визначити, як відношення молекулярної (формульної) маси до числа еквівалентності Z:
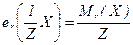 ;
;
де Z –число еквівалентності,
Мr – відносна молекулярна маса речовини Х.
Для молекул складної речовини Z відповідає кількість одиниць валентності, які зв’язують основні складові частини молекули.
Для оксиду – це число валентностей, що зв’язують елемент або подвоєне число атомів кисню.
Наприклад, для СаО – 4, Cr2O3 -6.
Для гідроксидів – кислотність або число груп ОН.
Наприклад, для КОН – 1, Mg(OH)2 -2.
Для солі - добуток числа атомів металу на його валентність.
Наприклад, для NaCl – 1, Fe2(SO4)3 -6.
В рівняннях реакцій Z речовини залежить від типу реакцій, в якій бере участь дана речовина. Так, у реакціях:
H2S + 2KOH = K2S + 2H2O
H2S + KOH = KHS + H2O
Одному молю H2SО4 відповідає 2 і 1 моль однокислотної основи КОН, тому Z (H2SO4) у першій реакції 2, а в другій – 1.
В окисно-відновних реакціях частинкою, еквівалентною одному атому Гідрогену є електрон. Тому 2 тут дорівнює кількості електронів, приєднаних або відданих атомом певного елемента в даній реакції.
Закон кратних відношень
Закон кратних відношень був сформульований у 1803р. Д. Дальтоном.
Якщо два елементи утворюють між собою декілька сполук, то вагові кількості одного елемента, що сполучається з однією й тією ж ваговою кількістю іншого, співвідносяться між собою як невеликі цілі числа.
З закону кратних відношень випливає два висновки:
- Склад речовин (дальтонідів) змінюється стрибком, тому, що в реакцію вступають цілі числа атомів;
- Кількість переходить в якість (веселящий газ N2O дуже відрізняється від безкольорової кристалічної речовини N2O5, що легко розкладається).
Приклад, що підтверджує закон.
Нітроген з Оксигеном утворюють п’ять оксидів молекулярної структури, де співвідношення між масовими кількостями Оксигену, що припадають на ту саму масову кількість азоту, дорівнює 1:2:3:4:5.
| Назва речовини Оксид | Склад оксиду, % | Відношення масових частин N і О | Відносний ваговий вміст N | |
| N | O | |||
| N2О | 63,7 | 36,4 | 1: 0,57 | |
| NО | 46,7 | 53,3 | 1: 1,14 | |
| N2О3 | 36,9 | 63,1 | 1: 1,71 | |
| NО2 | 30,5 | 69,5 | 1: 2,28 | |
| N2О5 | 25,9 | 74,1 | 1: 2,86 |
Отже, для кожного елемента є найменша масова кількість, яка може сполучатися з іншими елементами. Це найменша кількість елемента називається атомом.
Закон об'ємних відношень
За однакових умов об'єми газів, які вступають у реакцію відносяться між собою і до об'єму утворених газів, як невеликі цілі числа (Ж. Гей - Люссак, 1808р.).
У реакції горіння етану в кисні
2C2H6(г) + 7O2(г) = 4 CO2(г)+ 6H2O(г)
співвідношення об'ємів газів таке:
V (C2H6): V (O2): V (CO2): V (H2O) = 2:7:4:6
В символічній формі закон об'ємних відношень записується таким чином:
V (А): V (В): V (C): V (D) = a:b:c:d
а, b, с, d - коефіцієнти, які називаються стехіометричними.
Закон икористовується в реакціях з речовинами, які знаходяться в газоподібному стані, якщо об'єми вимірюються за однакових тиску та температури, тобто для розрахунків об'ємів газів за хімічними рівняннями.
Закон Авогадро






