Приклад 1. Поясніть причину утворення хімічного зв’язку. (див. додаток В).
Відповідь:
Проблема виникнення хімічного зв’язку є центральною в хімії, поскільки у природі і практиці людина має справи не з окремими атомами, а з речовинами. Навіть зовсім прості речовини, як правило, складаються не менш як з двох атомів хімічно зв’язаних між собою. Наприклад, відносна невелика кількість заліза 56 грам містить 6,02 ∙1023 атомів, які хімічно зв’язані між собою в кристалічну гратку.
Хімічний зв’язок утворюється під час взаємодії двох або кількох атомів, в результаті якої утворюється хімічно стійка дво- або багатоатомна система (наприклад, молекула або кристал). Хімічно зв’язані атоми – це складні утворення, які складаються з позитивно заряджених ядер і негативно заряджених електронів, між якими існує електростатична взаємодія.
Очевидно, система буде стійкою, якщо сили притягання більші від сил відштовхування. Утворення нових хімічних зв’язків супроводжується підвищенням електронної густини між атомами, яка притягує ядра. Цей процес супроводжується виділенням енергії, внаслідок чого енергія системи зменшується.
Історія розвитку проблеми хімічного зв’язку фактично є історією розвитку теоретичної хімії. Існують різні методи пояснення утворення хімічного зв’язку: механічні, електростатичні тощо. Одним з поширених на сьогодні методів є метод валентних зв’язків (МВЗ), згідно якого хімічний зв’язок утворюється за рахунок перекривання атомних орбіталей.
Приклад 2. Розкрийте зміст поняття „атомна орбіталь”.
Відповідь:
Атомна орбіталь (АО) володіючи певною енергією та відповідною формою є траєкторією руху електрона в полі ядра. Якщо електрон – частинка корпускулярна, то атомна орбіталь є однією з найважливіших характеристик. Електрон, володіючи крім властивостей частинки, має і хвильові властивості, які не можна характеризувати орбіталлю. Тому вводиться нове поняття про атомну орбіталь, яке охоплює корпускулярні та хвильові властивості електрона. Математично для одноелектронного атома Гідрогену це записується за допомогою рівняння Шредінгера:

де ψ (псі) – амплітуда електронної хвилі (хвильова функція, яка залежить від просторових координат і в загальному випадку від часу)
Переважно розглядається залежність хвильової функції від координат;
m – маса електрона;
h – постійна Планка;
E – повна енергія електрона;
U – потенціальна енергія електрона.
Таким чином в рівняння Шредінгера входить дві частини: перша – це сума похідних хвильової функції по координатах і друга частина рівняння містить різницю Е–U, яка дорівнює кінетичній енергії електрона.
Рівняння Шредінгера складне, точне його рішення потребує сучасної обчислювальної техніки.
Як модель стану електрону в атомі у квантовій механіці прийнято уявлення про електронну хмару, густина відповідних ділянок якої пропорційна ймовірності перебування там електрона. Електрон ніби „розмазаний ” навколо ядра по сфері, віддаленій від ядра на певну відстань. Одну з можливих форм електронної хмари атома можна зобразити так (рис. 5.1):

Рисунок 5.1 - Електронна хмара з нерівномірною густиною
Максимальна електронна густина відповідає найбільшій ймовірності перебування електрона. Очевидно чим міцніший зв’язок електрона з ядром, тим електронна хмара менша за розміром і компактніша за розподілом заряду.
Простір навколо ядра, в якому найімовірніше перебування електрона, називається атомною орбіталлю.
Поняття атомної орбіталі можна розглядати, як математичне поняття. Його можна уявляти собі як поверхню з максимальною електронною імовірністю. Ця поверхня може бути сферою – такі орбіталі відповідають s -підрівню і називаються s- орбіталлю. Що стосується р-орбіталей, то ця поверхня має форму гантелі, d- i f -орбіталі – складнішої форми.
Під „формою орбіталі” треба розуміти таку просторову геометричну модель, в межах якої перебування електрона найімовірніше. Форми граничних поверхонь s-, p- i
d- орбіталей можна зобразити наступним чином (рис. 5.2):

Рисунок 5.2 - Форми граничних поверхонь s-, p- i
d- орбіталей
Приклад 3. Поясніть утворення σ- і π-зв’язків.
Відповідь:
Спосіб утворення хімічних зв’язків області перекривання атомних орбіталей (АО) розміщених на лініях, що з’єднують центри (ядра) взаємодіючих атомів називається σ-зв’язком. Він здійснюється однією спільною електронною парою. Ці зв’язки виникають внаслідок перекривання двох s-орбіталей (молекула Н2), s- і
р -орбіталей (молекули HF, H2S), перекривання гібридних орбіталей з негібридними s- або р -орбіталями (молекули СН4, NH3, H2O, BCl3, BeCl3 тощо).
Схематично σ-зв’язки можна зобразити наступним чином (рис.5.3):
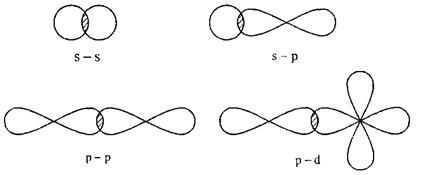
Рисунок 5.3 - Схематичне зображенняσ-зв’язків
Хімічні зв’язки, які утворюються в результаті перекривання орбіталей вздовж ліній, перпендикулярних до лінії, що зв’язує центри взаємодіючих атомів, називаються
π-зв’язками. Вони можуть утворюватись як р-, так і
d- електронами.
Схематично π-зв’зки можна зобразити наступним чином (5.4):

Рисунок 5.4 - Схематичне зображенняπ-зв’язків
Перекриття АО відбувається за рахунок однієї або двох областей перекриття. Якщо одна область перекриття, то хімічний зв’язок має назву σ-зв’язок, якщо дві – то хімічний зв’язок – π-зв’язок.
У випадку утворення хімічного зв’язку між двома атомами приймає участь більше, ніж одна пара електронів, то зв’язок називається кратним. Тоді один із них є σ-зв’язком.
Так у молекулі азоту утворюється потрійний зв’язок (N≡N). Усі зв’язки утворюються одноелектронними
р -орбіталями Нітрогену, але способи перекривання різні: один з них є σ-зв’язком, два інші – π-зв’язками (рис. 5.5):

Рисунок 5.5 - Схема утворення хімічних зв’язків в молекулі азоту
Приклад 4. Що таке гібридизація? Які її типи існують?
Відповідь:
Гібридизація – це перетворення початково нерівноцінних за енергією та формою орбіталей в однакові, рівноцінні під час утворення хімічних зв’язків.
Основні типи гібридизації атомних орбіталей (АО):
| Тип гібриди- зації | Число орбіталей, що гібридизується | Число гібридизованих АО | Будова молекули | Приклади |
| sp | 1 s і 1 p | лінійна | ZnCl2, CO2, BeCl2, H2S, C2H2 | |
| sp2 | 1 s і 2 p | трикутна | BF3, CO32-, C2H4 | |
| sp3 | 1 s і 3 p | тетраед-рична | NH3, CH4 |
 sp
sp
 sp2
sp2
 sp3
sp3
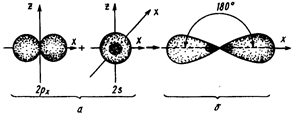
Рисунок 5.6 - Схема гібридизації атомних орбіталей (sp-, sp2 - i sp3 - гібридизація)
З наведених схем видно, як негібридизовані орбіталі (а) перетворюються у гібридизовані (б), змінюючи свою форму та просторове розташування.
Приклад 5. Наведіть орбітальні діаграми сполук BeCl2 (Ве в стані sp -гібридизації), BCl3 (В в стані
sp2 -гібридизації), CH4 (С в стані sp3 -гібридизації).
Відповідь:
Відповідно до існуючих уявлень про гібридизацію орбітальні діаграми виглядатимуть наступним чином
(рис 5.7):
а)
б) 

в)

а - BeCl2; б - BCl3; в - CH4
Рисунок 5.7 - Орбітальні діаграми сполук
Приклад 6. Які види зв’язків притаманні молекулам та який їх механізм утворення?
Відповідь:
| № п/п | Вид зв’язку | Визначення | Механізм утворення |
| Йонний | Зв’язок між йонами, що здійснюється завдяки електростатичному притяганню | 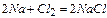 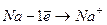 
| |
| Ковалентний | Зв’язок атомів за допомогою спільних електронних пар, тобто перекривання атомних орбіталей | Перекривання АО

| |
| Донорно-акцепторний (різновид ковалентного) | Зв’язок між атомами, один з яких має неподілену пару електронів, а інший - вільну АО |  N-донор,
N-донор,  -акцептор -акцептор
| |
| Металічний | Зв’язок у металах та сплавах між позитивно зарядженими йонами та валентними електронами, що є спільними для всіх йонів. | ||
| Водневий (міжмолеку-лярний) | Трицентровий зв’язок між двома електронегативними атомами через атом водню. | 
|
Приклад 7. Що характеризує електронегативність елементів (ЕН)?
Відповідь:
ЕН характеризує здатність атома притягувати до себе спільні електронні пари. Ця величина дає змогу встановити характер хімічного зв’язку, бо у багатьох сполуках зв’язок між атомами є проміжний між йонним і полярним ковалентним *.






