Приклад 8. Поєднайте величину електронегативності з типом хімічного зв’язку і властивостями наступних речовин:  ,
,  ,
,  ,
, 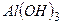
Відповідь:
| Формула речовини | Різниця ЕН | Вид зв’язку * | Властивості сполук |

|  
| Ковалентний полярний | Кислотні

|

|  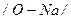


| Йонний Ковалентний полярний | Основні
 бо бо  -полярніший -полярніший
|

| 

 
| Ковалентний полярний | Кислотні

 полярніший полярніший
|
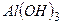
| 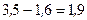



| Ковалентний полярний | Амфотерні

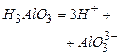 полярності близькі
полярності близькі
|
Приклад 9. Чому молекули здатні до поляризації?
Відповідь:
Полярність і неполярність молекули залежить від характеру розподілу електронної густини. У неполярних молекулах центри зосередження позитивних і негативних зарядів збігаються. У полярних молекулах електронна хмара розміщена несиметрично, внаслідок чого виникають позитивні і негативні центри, які називаються полюсами. Вони розташовані на певній відстані l один від одного. Полярні молекули називають диполями.
Полярність молекули оцінюють величиною дипольного моменту μ, що є добутком відстані l між полюсами (плече диполя) на їх заряд q:
μ = l ∙ q
Так, у молекулах Н2, О2, Cl2, N2 хімічні зв’язки неполярні, електронна хмара розміщена симетрично між атомами (μ = 0). У молекулах галогеноводнів електронна хмара зміщена до більш електронегативного атома галогену, на якому виникає частковий негативний заряд δ-, а на атомі Гідрогену – частковий позитивний заряд δ+.
Атоми в молекулі мають певне просторове розміщення, тобто свою геометрію.
Наприклад, в молекулі води кут між лініями зв’язку (валентний кут) дорівнює 104,50, ці полюси просторово не збігаються і молекула води – полярна:

Приклад 10. Опишіть просторову структуру наступних молекул:  ,
, 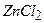 ,
, 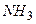 .
.
Відповідь:
Бор флуорид  . Просторова структура цієї молекули визначається тим, що при утворенні зв’язку
. Просторова структура цієї молекули визначається тим, що при утворенні зв’язку  проходить гібридизація однієї
проходить гібридизація однієї  - і двох
- і двох  - орбіталей атома
- орбіталей атома  (sp2- гібридизація), при цьому утворюється три однакові
(sp2- гібридизація), при цьому утворюється три однакові  гібридні орбіталі, які розміщені під кутом 120 º. Таким чином,
гібридні орбіталі, які розміщені під кутом 120 º. Таким чином,  - плоска молекула із кутом 120 º між зв’язками.
- плоска молекула із кутом 120 º між зв’язками.
Цинк хлорид 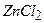 . При утворенні молекул типу
. При утворенні молекул типу  (
( галоген або Гідроген) проходить
галоген або Гідроген) проходить  - гібридизація орбіталей центрального атома, і виникають хімічні зв’язки, які направлені під кутом 180° один від одного. Молекули даного типу лінійні.
- гібридизація орбіталей центрального атома, і виникають хімічні зв’язки, які направлені під кутом 180° один від одного. Молекули даного типу лінійні.
Амоніак. При утворенні зв’язку відбувається гібридизація однієї і трьох -орбіталей атома азоту; три -гібридні орбіталі беруть участь в утворенні трьох зв’язків, а четверта орбіталь зайнята неподіленою електронною парою. Молекула має форму трикутної піраміди із атомом азоту у вершині. Величина кута між зв’язками відрізняється від характерного для -гібридизації значення - вона рівна.
Приклад 11. Чим відрізняються аморфні речовини від кристалічних?
Відповідь:
Структура аморфних речовин нерегулярна, у них відсутня кристалічна гратка.
Приклад 12. Чим відрізняється плавлення речовин з різними кристалічними гратками: а) йонною; б) атомною; в) молекулярною?
Відповідь:
Сили притягання між атомами в атомній гратці і між йонами в йонній гратці дуже великі, тому речовини із такими типами кристалічної гратки мають високі температури плавлення. І навпаки, сили взаємодії в молекулярній гратці невеликі, тому такі речовини мають низькі температури плавлення.
Приклад 13. Який тип кристалічної гратки характерний для речовин, формули яких приведені: а)  ;
;
б)  ; в)
; в) 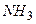 ; г)
; г)  ; д)
; д)  ;
;
е)  .
.
Відповідь:
 ,
, 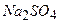 ,
,  - йонні кристалічні гратки;
- йонні кристалічні гратки; 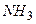 ,
, 
 ,
,  - молекулярні.
- молекулярні.
Приклад 14. Наведіть приклади речовин із різними типами кристалічних ґраток.
Відповідь:
| Тип гратки | Атомна | Йонна | Молекулярна | Металічна |
| Приклад | 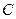 (алмаз) (алмаз)


| 


| 
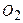
 , , 
| 


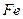 Сплави
Сплави
|
Приклад 15. Що називається ступінню окиснення? В чому проявляється подібність і відмінність із поняттям “ валентність ”?
Відповідь:
Ступінь окиснення – це умовний заряд атома у сполуці, обчислений із припущення, що сполука складається із йонів. Валентність – це число хімічних зв’язків (число загальних електронних пар), які утворені атомом в сполуці. Ступінь окиснення співпадає із валентністю для атомів металів у всіх сполуках і деяких сполуках неметалів (наприклад, для Сульфуру  ,
,  , для Фосфору в
, для Фосфору в  і
і  ). На відмінність від валентності ступінь окиснення буває негативним.
). На відмінність від валентності ступінь окиснення буває негативним.
Приклад 16. Визначте ступінь окиснення Мангану в сполуках:  і
і  .
.
Відповідь:  ,
,  .
.
Приклад 17. Складіть графічні формули сполук: 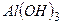 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  .
.
Відповідь:
Спочатку необхідно зазначити ступені окиснення атомів в молекулі і встановити скільки електронів має кожний атом на зовнішньому енергетичному рівні, тобто визначити його валентність – число зв’язків, які може утворити цей атом.
Почнемо із алюміній гідроксиду 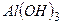 . Ця молекула складається із катіона
. Ця молекула складається із катіона  і аніона
і аніона  . Атом Алюмінію має три електрони на зовнішньому енергетичному рівні і може зв’язатися із трьома гідроксогрупами. Гідроксид-іон складається із атомів Оксигену і Гідрогену. Атом Оксигену має два неспарених електрони на зовнішньому енергетичному рівні і може зв’язатися з одним атомом Гідрогену і одним атомом Алюмінію. Користуючись цими міркуваннями складаємо графічну формулу:
. Атом Алюмінію має три електрони на зовнішньому енергетичному рівні і може зв’язатися із трьома гідроксогрупами. Гідроксид-іон складається із атомів Оксигену і Гідрогену. Атом Оксигену має два неспарених електрони на зовнішньому енергетичному рівні і може зв’язатися з одним атомом Гідрогену і одним атомом Алюмінію. Користуючись цими міркуваннями складаємо графічну формулу:

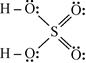
Молекулу сульфатної кислоти  можна подати як сполуку, яка складається із двох атомів Гідрогену, чотирьох атомів Оксигену і атома Сульфуру. Тепер їх потрібно зв’язати між собою. Атом Сульфуру має на зовнішньому енергетичному рівні 6 неспарених (валентних) електронів, так як знаходиться в шостій групі головній підгрупі. Атом Сульфуру може утворювати шість зв’язків з різними атомами. Але кожний із атомів Оксигену, який не входить до складу Гідроксид-іонів, повинний утворити по два зв’язки (тобто подвійний зв’язок). Виходячи із цього складаємо формулу:
можна подати як сполуку, яка складається із двох атомів Гідрогену, чотирьох атомів Оксигену і атома Сульфуру. Тепер їх потрібно зв’язати між собою. Атом Сульфуру має на зовнішньому енергетичному рівні 6 неспарених (валентних) електронів, так як знаходиться в шостій групі головній підгрупі. Атом Сульфуру може утворювати шість зв’язків з різними атомами. Але кожний із атомів Оксигену, який не входить до складу Гідроксид-іонів, повинний утворити по два зв’язки (тобто подвійний зв’язок). Виходячи із цього складаємо формулу:
Наступні сполуки будуть мати графічні формули:



Пунктир означає, що зв’язок делокалізований (рівномірно розподілений) між атомами.



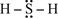

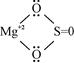


Сполука  являється йонною сполукою і може розглядатися як
являється йонною сполукою і може розглядатися як  .
.
Приклад 18. Визначте валентність і ступінь окиснення Карбону в сполуках: а)  ; б)
; б)  .
.
Відповідь: Запишемо структурні формули даних сполук:

З формул випливає, що Карбон у них чотиривалентний.
Враховуючи, що ступінь окиснення Оксигену (крім сполук з Флуором і пероксидів) завжди “-2”, а ступінь окиснення Гідрогену “+1” (крім гідридів), знаходимо з принципу електронейтральності молекул ступінь окиснення Карбону:
а) в  .
. 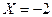 ;
; 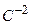
б) в  .
.  ;
; 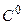 .
.






