1 Принцип мінімуму енергії: найстійкішому стану ē в атомі відповідає мінімальна енергія, тобто електрон займає АО з найнижчою енергією.
2 Принцип Паулі: Атом не може мати двох електронів з однаковими значеннями всіх чотирьох КЧ.
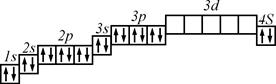
3 Правило Клечковського: Енергетичні підрівні заповнюються за зростанням суми n+ l (вказує послідовність заповнення підрівнів).
4 Правило Гунда: Сумарне спінове число електронів певного підрівня повинно бути максимальним (вказує порядок заповнення рівноцінних АО
| ↑ | ↑ | ↑ | ↑↓ | ↑ |
вірно невірно).
Приклад 6. В якій послідовності заповнюються атомні орбіталі електронами?
Відповідь:
В багатоелектронних атомах заповнення електронами всіх енергетичних рівнів і підрівнів залежно від їхньої енергії відбувається у такій послідовності:
| n | |||||||
| АО | 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
де n – енергетичний рівень; АО – атомна орбіталь.
Приклад 7. Які існують способи зображення електронних структур атомів.
Відповідь:
Існує декілька умовних способів зображення електронних структур атомів:
а) за допомогою формул Льюїса (електронно-крапкових символів), у яких зовнішні валентні електрони позначаються крапками, а ядра разом з внутрішніми електронами – хімічними символами елементів, наприклад:
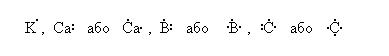
Написання двох формул для одного і того ж елемента вказує на стан атома (основний або стаціонарний і збуджений);
дві розміщені поряд крапки означають пару електронів з протилежними спінами, що належать до однієї орбіталі;
б) у вигляді електронних формул або електронних конфігурацій, які дають змогу враховувати послідовність заповнення рівнів, наприклад, повна електронна формула для V 1s22s22p63s23p64s23d3, скорочена V 4s23d3 або KLM 4s23d3 (де KLM – умовне позначення енергетичних рівнів);
іноді скорочену формулу позначають символами інертних елементів, що органічно входять до структури атомів наступних елементів (наприклад для Ванадію [ Ar ] 4s23d3)
Якщо потрібно підкреслити, що електрони певного підрівня заповнюють орбіталі по одному, то орбітальне квантове число позначають з індексом, який вказує на орієнтацію орбіталі у просторі, наприклад для Ванадію V 4s2 3d'х 3d' у 3d'z.
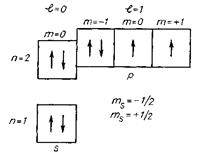
в) метод квантових комірок, який використовує всі чотири квантові числа. Кожному підрівню відповідає певна кількість комірок, що дорівнює числу можливих значень магнітного квантового числа. Якщо на одному рівні є декілька підрівнів, то енергія їх зростає у напрямку вгору або вниз для позначення орієнтації спінових моментів, наприклад, схема електронної структури атома Флуору у вигляді квантових комірок:
Приклад 8 Складіть повну, скорочену та графічні формули елемента з порядковим номером 20.
Відповідь: За порядковим номером робимо висновок, що в атомі є 20 електронів. Це елемент Кальцій.
Його повна електронна формула має вигляд:
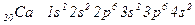
Повну електронну формулу ще називають електронною конфігурацією або електронною структурою.
Скорочена електронна формула 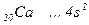 .
.
Графічна електронна формула (формула Паулі):
Зміст позначень, які використовуються в графічній формулі:

Приклад 9. Атом елемента має на 7 електронів більше, ніж йон натрію. Назвіть елемент, складіть електронні формули його атома у незбудженому та збудженому станах. Вкажіть число валентних електронів у цих станах.
Відповідь: Атом натрію має електронну формулу:
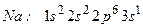 (11 електронів)
(11 електронів)
Йон натрію 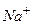 матиме завершену електронну оболонку на другому енергетичному рівні:
матиме завершену електронну оболонку на другому енергетичному рівні:
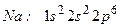 (10 електронів)
(10 електронів)
Наступні сім електронів розташовані відповідно на 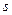 і
і 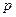 підрівнях третього рівня. Сумарна кількість електронів буде:
підрівнях третього рівня. Сумарна кількість електронів буде:
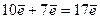 .
.
Електронна формула елемента:
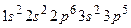
Цей елемент - Хлор. Він має незаповнений  -підрівень. На цей підрівень і переходять електрони з
-підрівень. На цей підрівень і переходять електрони з 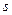 і
і 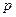 підрівня третього рівня в збудженому стані.
підрівня третього рівня в збудженому стані.
Як правило, на орбіталях зображають електрони останнього енергетичного рівня. Тоді розподіл електронів в незбудженому стані наступний:
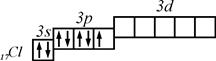
В збудженому стані на  -підрівень може переходити відповідно один, два і три електрони. Тому для збудженого стану характерні три можливі комбінації відповідно з трьома, п’яти та семи неспареними електронами:
-підрівень може переходити відповідно один, два і три електрони. Тому для збудженого стану характерні три можливі комбінації відповідно з трьома, п’яти та семи неспареними електронами:

Валентні електрони – це ті електрони, які знаходяться на атомних орбіталях неспареними.
В незбудженому стані атом 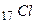 має один валентний електрон.
має один валентний електрон.
В збуджених: а) стані – 3
б) стані – 5
в) стані – 7
Приклад 10. На основі теорії будови атомів поясніть суть явища періодичності і зміни хімічних властивостей елементів.
Відповідь: Періодичність зміни хімічних властивостей елементів і їх сполук пояснюється періодичною зміною конфігурації валентних електронів (електронів на зовнішньому енергетичному рівні) із збільшенням заряду ядра.






