Приклад 1. Суть структури періодичної системи
Д.І. Менделєєва.
Відповідь:
Періодична система елементів або таблиця – це графічний вираз періодичного закону Д.І. Менделєєва.
Періодична система (ПС) складається з 7 періодів та 8 груп. Період, який складається з одного ряду, називається малим, а з двох рядів – великим.
Група складається з двох підгруп головної і побічної.
Періоди – горизонтальні ряди ПС, що починаються лужним металом і закінчуються інертним газом.
Номер періоду відповідає числу енергетичних рівнів, на яких розміщуються електрони.
Групи – вертикальні стовпчики, що містять подібні за властивостями елементи.
Номер групи визначає максимальну кількість валентних (неспарених) електронів.
Головні підгрупи складаються з елементів малих і великих періодів. Елементи кожної підгрупи – хімічні аналоги.
Побічні підгрупи складаються лише з елементів великих періодів.
Приклад 2. Як змінюються властивості елементів у періодичній системі.
Відповідь:
Схожість хімічних властивостей елементів пов’язана з періодичним повторенням будови валентних підрівнів.
Металічні властивості – це здатність атома віддавати валентні електрони.
Неметалічні властивості – це здатність атома приєднувати електрони до завершення рівня.
В головних підгрупах посилюються ↑
В періодах посилюються →
Вища валентність – це число неспарених електронів за Оксигеном зовнішніх енергетичних рівнів у збудженому стані.
У головних підгрупах – стала.
В періодах зростає →
Атомний радіус у головних підгрупах зростає ↓,
в періодах зростає ←.
Електронегативність – це здатність атомів притягувати до себе валентні електрони.
В головних підгрупах в основному зростає ↑.
В періодах зростає →.
Енергія йонізації – це енергія, яка потрібна для відривання електрона від атома.
В головних підгрупах зростає ↑.
В періодах зростає →.
Приклад 3. Поясніть суть ефектів d- i f-стиснення.
Відповідь:
Зміна радіусів атомів елементів у періодичній системі має періодичний характер. У періодах атомні та йонні радіуси елементів із збільшенням заряду ядра атома, як правило, зменшується. Максимальне зменшення радіусів спостерігається в атомах та йонах елементів малих періодів. Це можна пояснити посиленням притягання електронів зовнішнього шару до ядра в міру зростання його заряду. Для елементів великих періодів характерне плавніше зменшення радіусів атомів та йонів елементів, що зумовлено наявністю
d- та f-підрівнів. Такий ефект називається d- i f-стисненням. Ці ефекти пояснюються тим, що в атомах f-елементів (а також d- елементів) число електронних шарів однакове. Однак, із збільшенням заряду ядра посилюється притягання електронів до ядра, внаслідок чого радіуси йонів зменшуються.
Це явище має один важливий наслідок. Наприклад, в результаті f-стиснення (лантаноїдного стиснення) розміри атомів та йонів елементів шостого періодів, розміщених відразу після лантаноїдів (Нf, Та, W і далі), дуже близькі до розмірів атомів та йонів відповідних елементів п’ятого періоду (Zr, Nb, Mo і т.д.). Для елементів четвертого і п’ятого періодів ці характеристики помітно розрізняються.
Атоми і йони аналогічних елементів побічних підгруп п’ятого і шостого періодів мають подібну електронну будову та розміри, тому в хімічних властивостях спостерігається значно більша подібність, ніж у випадку елементів четвертого і п’ятого періодів. Так, цирконій за своїми властивостями стоїть значно ближче до гафнію, ніж до титану, ніобій подібний до танталу більше, ніж до ванадію і т.д.
Приклад 4. Чому розділення хімічних елементів на дві групи – метали і неметали – є неточним і неповним?
Відповідь:
Існує багато елементів, які проявляють властивості як металів, так і неметалів в залежності від валентності (ступеня окиснення). Наприклад, двовалентний Хром утворює основний оксид  і гідроксид
і гідроксид  :
:

Сполуки тривалентного хрому  і гідроксид
і гідроксид 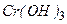 - амфотерні і реагують як з кислотами, так і з основами:
- амфотерні і реагують як з кислотами, так і з основами:


Хром із ступенем окислення  утворює типовий кислотний оксид
утворює типовий кислотний оксид  :
:

Приклад 5. Хімічний елемент Галій  подібний до елемента Алюмінію
подібний до елемента Алюмінію  , а Селен
, а Селен  до Сульфуру
до Сульфуру  . Напишіть формули оксидів, гідроксидів і солей, до складу яких входять ці елементи. Напишіть рівняння реакцій, які характеризують хімічні властивості відповідних сполук.
. Напишіть формули оксидів, гідроксидів і солей, до складу яких входять ці елементи. Напишіть рівняння реакцій, які характеризують хімічні властивості відповідних сполук.
Відповідь:
Оксиди  і
і  , та гідроксиди
, та гідроксиди  і
і 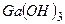 - типові амфотерні сполуки, які реагують як з кислотами, так і з основами:
- типові амфотерні сполуки, які реагують як з кислотами, так і з основами:


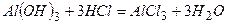

 - в розчині
- в розчині
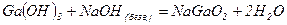
Селен і сірка утворюють по два кислотних оксиди -  і
і  (їм відповідають кислоти
(їм відповідають кислоти  і
і  ),
),  і
і  (їм відповідають кислоти
(їм відповідають кислоти 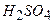 і
і  ). Всі ці сполуки реагують із лугами і основними оксидами, утворюючи солі (сульфіти і селеніти, сульфати і селенати):
). Всі ці сполуки реагують із лугами і основними оксидами, утворюючи солі (сульфіти і селеніти, сульфати і селенати):




Приклад 6. Розташуйте оксиди в порядку зростання кислотних властивостей  ,
, 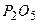 ,
,  ,
,  ,
,  . Відповідь обґрунтуйте.
. Відповідь обґрунтуйте.
Відповідь:
Знаходимо в періодичній таблиці місцеположення елементів, які дають відповідні оксиди. З таблиці видно, що два елементи  і
і  належать до одного періоду. Виходячи з правила, що із зростанням протонного числа елемента в елементів одного періоду неметалічні властивості посилюються, приходимо до висновку, що оксид
належать до одного періоду. Виходячи з правила, що із зростанням протонного числа елемента в елементів одного періоду неметалічні властивості посилюються, приходимо до висновку, що оксид 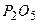 буде мати більш виражені кислотні властивості, ніж
буде мати більш виражені кислотні властивості, ніж 
Елементи  ,
,  ,
,  і
і 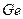 - це елементи четвертої групи головної підгрупи. З ростом протонного числа цих елементів зростають їх радіуси і зв’язок електронів зовнішнього енергетичного рівня з ядром слабшає. Зростає здатність віддавати ці електрони, тобто посилюються металічні властивості і, відповідно, понижуються кислотні властивості (кислотні оксиди дають неметали, основні – метали). Так,
- це елементи четвертої групи головної підгрупи. З ростом протонного числа цих елементів зростають їх радіуси і зв’язок електронів зовнішнього енергетичного рівня з ядром слабшає. Зростає здатність віддавати ці електрони, тобто посилюються металічні властивості і, відповідно, понижуються кислотні властивості (кислотні оксиди дають неметали, основні – метали). Так, 
 ,
,  і
і  проявляють амфотерні властивості, а
проявляють амфотерні властивості, а  - тільки кислотні. Таким чином, оксиди в порядку зростання кислотних властивостей можна розташувати в ряд:
- тільки кислотні. Таким чином, оксиди в порядку зростання кислотних властивостей можна розташувати в ряд:  ,
,  ,
,  ,
,  ,
, 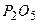 .
.






