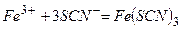Приклад 1. В чому проявляється важливість вивчення комплексних сполук?
Відповідь:
Важливою властивістю багатьох комплексних сполук є їх здатність прискорювати хімічні та біохімічні реакції. Механізми майже всіх каталітичних реакцій ґрунтується на утворенні проміжних активованих комплексів.
Деякі комплексні сполуки металів з органічними сполуками є біологічними каталізаторами – ферментами. До них відносяться хлорофіл, вітаміни, ген крові. Такі мікроелементи, як Цинк, Кобальт, Купрум, Бор, Магній, Хром, в процесах життєдіяльності організмів перебувають у формі комплексних сполук.
Різноманітні комплексні сполуки з неорганічними й органічними лігандами широко застосовують під час очистки різних екологонебезпечних об’єктів, добування дорогоцінних металів.
В хімічному аналізі (комплексометричному, гравіметричному, титриметричному, колориметричному,) з їх допомогою визначають йони, маскують сторонні йони, розчиняють осади.
Приклад 2. Чим відрізняються комплексні сполуки від подвійних?
Відповідь:
До комплексних сполук дуже подібні так звані подвійні солі, до яких належать галуни K2SO4 ∙ Al2(SO4)3 ∙ 24H2O, KCr(SO4)2 ∙ 10H2O тощо.
Назву „комплексна сполука” часто пов’язують з назвою „подвійні солі”, тому що їх можна розглядати як продукти, що утворені двома металами та однією кислотою:
Na2SO4 + Al2(SO4)3 = 2Na[Al(SO4)2] подвійна сіль
NaCN + AgCN = Na[Ag(CN)2] комплексна сполука
Складні солі, які під час розчинення дисоціюють тільки на ті йони, що входили до складу сполук, наприклад:
Na[Al(SO4)2] ↔ Na+ + Al3+ + 2SO42-
Комплексні солі дисоціюють з утворенням складних комплексних йонів:
Na[Ag(CN)2] ↔ Na+ + [Ag(CN)2]-
Чітко розділити подвійні і комплексні солі неможливо. Кількісною характеристикою, за якою їх можна визначити є константа нестійкості. Якщо Кнест . › 10-1, то таку сіль можна вважати подвійною.
Приклад 3. Які сполуки називаються комплексними? Яка їх будова і особливості хімічного зв’язку?
Відповідь:
Комплексними (або координаційними) називаються сполуки, кристалічні гратки яких складаються з комплексних груп, утворених внаслідок взаємодії йонів або молекул, здатних існувати самостійно. Прикладом їх утворення можуть бути наступні реакції:
Fe(CN)2 + 4KCN = K4[Fe(CN)6]
ZnSO4 + 4NH3 = [Zn(NH3)4]SO4
Розглянемо будову комплексних сполук.
В молекулі є атом із позитивним ступенем окиснення, який об’єднує довколо себе всі інші частинки.
Цей атом називають комплексоутворювачем або центральним атомом. В наших прикладах Fe+2 і Zn+2.
Найбільшу схильність до утворення комплексів мають катіони d – елементів, наприклад, Fe2+,Fe3+,Co3+,Cr3+,Cu2+,Ti4+ тощо, рідше – атоми елементів головних підгруп періодичної системи з позитивним ступенем окиснення, наприклад, Be+2, Al+3, а також неметали з високим ступенем окиснення (B+3,Si+4,P+5 тощо).
Приєднані до комплексоутворювача частки (молекули, аніони) називаються лігандами. Ліганд може утворювати з комплексоутворювачем один або кілька хімічних зв’язків. Число хімічних зв’язків, що утворює ліганд з комплексоутворювачем, називається дентатністю, які ділять на монодентатні: F−, Cl−, C N−, H2 O і інші. (Підкреслений атом, який утворює зв’язок з комплексоутворювачем). Полідентатними є найчастіше органічні йони і молекули.
Загальне число атомів усіх лігандів або груп атомів, що утворюють зв’язки з комплексоутворювачем, називають координаційним числом комплексоутворювача (КЧ).
Значення координаційного числа залежить від багатьох факторів: від природи лігандів, від співвідношення радіусів лігандів і комплексоутворювача, умов проведення процесів комплексоутворення. Але основним фактором, який впливає на координаційне число, являється ступінь окиснення комплексоутворювача:
| ступінь окиснення комплексоутворювача | +1 | +2 | +3 | +4 | вище +4 |
| координаційні числа | 4;6 | 6;4 | 8-12 |
(підкреслені найбільш характерні координаційні числа).
Комплексоутворювач і ліганди складають комплексний йон, або внутрішню сферу комплексу в хімічній формулі її відокремлюють квадратними дужками; наприклад,
[Fe(CN)6]4-, [Zn(NH3)4]2+.
Йони, що знаходяться за межами внутрішньої сфери, утворюють зовнішню сферу комплексу (в наших прикладах це K+ і SO42 -).
Для комплексних сполук діамінаргентум (І) хлорид [Ag(NH3)2]Cl і гексаамінкобальт (ІІІ) бромід [Co(NH3)6]Br3 схематично зовнішню і внутрішню сфери можна зобразити так:
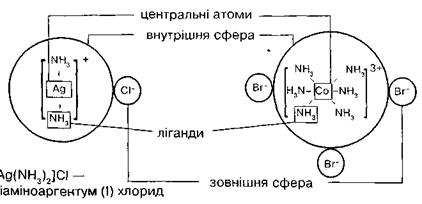
Рисунок 6.1 – Схематичне зображення будови комплексних сполук [Ag(NH3)2]Cl та [Co(NH3)6]Br3.
Для комплексної сполуки [Be(H2O)4]SO4 утворення хімічних зв’язків можна зобразити так:
|
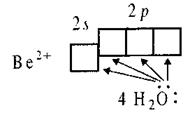
У атома берилію валентними є підрівні 2s22p0, у йона Be2+ - на два електрони менше (2s02p0). Вільні 2s і 2p орбіталі Be2+ заповнюються валентними електронами ліганду утворюючи sp3 -гібридизацію. Молекула має тетраедричну будову.
Приклад 4. Як розраховується ступінь окиснення комплексоутворювача та заряд внутрішньої сфери?
Відповідь:
Ступінь окиснення комплексоутворювача дорівнює алгебраїчній сумі ступенів окиснення лігандів і йонів зовнішньої сфери, взятій з протилежним знаком.
Наприклад:
K4[Fe(CN)6]: -[6∙(-1) + 4∙(+1)] = +2; Fe+2
[Zn(NH3)4]SO4: -(-2 + 6∙0) = +2; Zn+2
Заряд комплексного йону дорівнює сумі зарядів комплексоутворювача і лігандів; з другої сторони, він дорівнює сумарному заряду зовнішньої сфери з протилежним знаком.
Наприклад:
K4[Fe(CN)6]: +2+6∙(-1)= -4 або –[4∙(+1)]=-4; [Fe(CN)6]4-
[Zn(NH3)4]SO4: +2 +4∙0 = +2; [Zn(NH3)4]2+
Приклад 5. Які основні принципи побудови назв сполук з аніонними, катіонними та нейтральними комплексами?
Відповідь:
а) Назва комплексної сполуки, що містить комплексний аніон, складається із двох слів: перше – назва катіону в називному відмінку; друге – назва комплексного аніону в називному відмінку, в якому перелічуються координаційні числа і назви лігандів, назва комплексоутворювача (корінь латинської назви елемента з закінченням „ат”, ступінь окиснення комплексоутворювача (римською цифрою в дужках)).
Координаційні числа в назвах комплексних сполук вказують грецькими числівниками:
2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, (координаційне число 1 в назві не зазначається).
Назви лігандів: негативно заряджені ліганди називають, добавляючи до кореня латинської назви елемента чи до назви складного аніону сполучну голосну „о”: Cl - – хлоро-, Br - – бромо-, CN - – ціано-, OH - – гідроксо-, NO3 - – нітрато-, NO2 - – нітрито-, S2O32- – тіосульфато-, S2 - – тіо-, NH2- – амідо-, NH4+ – амоно-, H- – гідридо-, CN− – ціанато-,
SCN - – тіоціанато-, NCS- – ізотіоціанато-, C2O42- – оксалато-.
Назви лігандів перелічуються в алфавітному порядку і вважають єдиним цілим.
Наприклад:
↓
K3 [  (CN)6] калій гексаціаноферат (ІІІ)
(CN)6] калій гексаціаноферат (ІІІ)
↑ ↑ ↑ ↑
1 4 3 2
↓
Na [ 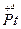 (NH3) Br5 ] натрій пентабромоамінплатинат (ІV)
(NH3) Br5 ] натрій пентабромоамінплатинат (ІV)
↑ ↑ ↑ ↑ ↑
1 5 4 3 2
де 1,2,...5 – порядок назв складових комплексної сполуки.
б) Назва комплексної сполуки, що містить комплексний катіон, також складається з двох слів: перше слово – назва комплексного катіону, в якій перелічуються координаційні числа, назва лігандів та назва комплексоутворювача (українська назва елемента), ступінь окиснення комплексоутворювача з римською цифрою в дужках; друге – назва аніону.
Наприклад:
↓
[ 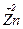 (NH3)4] SO4 тетраамінцинк сульфат
(NH3)4] SO4 тетраамінцинк сульфат
↑ ↑ ↑ ↑
3 2 1 5
(так як цинк в сполуках проявляє лише один ступінь окиснення +2, то її в назві можна не приводити).
↓
[ 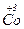 (H2O) 6 ] Br3 гексааквакобальт (ІІІ) бромід
(H2O) 6 ] Br3 гексааквакобальт (ІІІ) бромід
↑ ↑ ↑ ↑
3 2 1 5
де 1,2,...5 – порядок назв складових комплексної сполуки.
в) Назва сполуки, яка немає зовнішньої сфери, складається з одного слова, в якому перелічені координаційні числа, назви лігандів і назва комплексоутворювача, ступінь окиснення комплексоутворювача не вказується, так як вона визначається сумою зарядів лігандів.
Наприклад:
 ↓
↓
[ 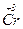 (H2O)3F3] трифлуоротриаквахром (ІІІ)
(H2O)3F3] трифлуоротриаквахром (ІІІ)
↑ ↑ ↑↑ ↑
5 4 3 21
Приклад 6. Яким чином дисоціюють у водних розчинах комплексні сполуки?
Відповідь:
Більшість комплексних сполук добре розчинні у воді і в розчині дисоціюють на йони. Частинки зовнішньої сфери, зв’язані з комплексними йонами електростатичними силами, легко відщеплюються в розчині. Така дисоціація називається первинною, під час якої відбувається повний розпад на йони внутрішньої і зовнішньої сфери.
Ліганди, які знаходяться у внутрішній сфері, зв’язані з комплексоутворювачем дуже міцно і відщеплюються лише в малій степені. Ця дисоціація називається вторинною. Процес вторинної дисоціації обернений і його рівновага зміщена в сторону утворення комплексного йону.
Наприклад:
дисоціації:
K2[PtCl6] → 2K+ + [PtCl6]2- первинна
[PtCl6]2- ↔ Pt4+ + 6Cl- вторинна
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl- первинна
[Ag(NH3)2]+ ↔ Ag+ + 2NH3 вторинна
Комплексні сполуки, які не мають зовнішньої сфери, не піддаються первинній дисоціації і тому їх називають комплексними неелектролітами. Вторинна дисоціація цих сполук відбувається дуже слабо.
Наприклад:
[Cr(H2O)3F3] ↔ Cr3+ + 3H2O +3F−
Процеси дисоціації оборотні та ступінчасті і з кількісного боку оцінюються константою стійкості:
Кст. = 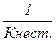
Константа рівноваги процесу дисоціації комплексних йонів називається константою нестійкості комплексної сполуки. Для сполуки [Zn(NH3)4Cl2].
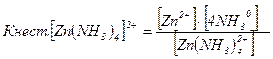
Величина константи нестійкості комплексної сполуки залежить від її природи і від температури. За сталої температури ця величина стала для даної сполуки і не залежить від її концентрації.
Дисоціація комплексних йонів відбувається ступінчасто:
[Zn(NH3)4]2+ ↔ [Zn(NH3)3]2+ + NH3
[Zn(NH3)3]2+ ↔ [Zn(NH3)2]2+ + NH3
[Zn(NH3)2]2+ ↔ [Zn(NH3)]2+ + NH3
[Zn(NH3)]2+ ↔ Zn2+ + NH3
Кожному з рівнянь відповідає певна константа нестійкості (ступінчаста константа нестійкості). Значення цих констант нестійкості наводяться в довідниках з хімії, за їх значеннями можна передбачити перебіг реакції.
Приклад 7. Визначте ступені окиснення комплексоутворювачів, заряди комплексних йонів, координаційні числа, вкажіть ліганди, назвіть комплексні сполуки, напишіть рівняння їх дисоціації:
H[Au(SCN)2]
[Cr(H2O)5Cl]Cl2
[Pd(NH3)2I2]
Відповідь:
1. H[Au(SCN)2]
Комплексоутворювач: Au+1; його заряд – [2(-1) + (+1)] = +1 Комплексний йон: [Au(SCN)2] −; його заряд +1 +2 (-1) = -1
Координаційне число (КЧ): 2
Ліганди: SCN-
Назва сполуки: гідроген дитіоціаноаурат (І) або дитіоціаноауритна кислота.
Первинна дисоціація:
H[Au(SCN)2] → H+ + [Au(SCN)2]-
Вторинна дисоціація:
[Au(SCN)2]- ↔ Au+ + 2SCN-
2. [Cr(H2O)5Cl]Cl2
Комплексоутворювач: Cr+3; його заряд – [3(-1) + 5∙0] = +3 Комплексний йон: [Cr(H2O)5Cl]2+; його заряд +3 + (-1) = +2
Координаційне число (КЧ): 5 + 1 = 6
Ліганди: H2O, Cl-
Назва сполуки: хлоропентааквахром (ІІІ) хлорид;
Первинна дисоціація:
[Cr(H2O)5Cl]Cl2 → [Cr(H2O)5Cl]2+ + 2Cl-
Вторинна дисоціація:
[Cr(H2O)5Cl]2+ ↔ Cr3+ + 5H2O + Cl-
3. [Pd(NH3)2I2]
Комплексоутворювач: Pd2+; його заряд – [2(-1) + 2∙0] = +2 Комплексного йону немає – це комплексний неелектроліт
Координаційне число (КЧ): 2 +2 = 4
Ліганди: NH3, I-
Назва сполуки: дийододіамінпаладій
Первинної дисоціації немає.
Вторинна дисоціація:
[Pd(NH3)2I2] ↔ Pd2+ + 2 NH3 + 2I-
Приклад 8. Напишіть хімічні формули таких сполук:
1. Калій тетранітритодіамінкобальтат (ІІІ);
2. Динітритохлоротриамінхром;
3. Тетрааквакадмій нітрат.
Відповідь:
1. K[Co(NH3)2(NO2)4]
2. [Cr(NH3)3Cl(NO2)2]
3. [Cd(H2O)4](NO3)2
Приклад 9. Запишіть рівняння реакцій, що є якісними на йони 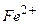 ,
, 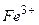 .
.
Відповідь:
Якісна реакція на 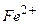 :
:
Під час дії червоної кров’яної солі 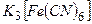 на солі ферум (ІІ) утвориться синій осад (турнбулева синь):
на солі ферум (ІІ) утвориться синій осад (турнбулева синь):
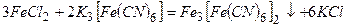
або 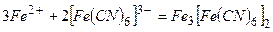
Якісні реакції на 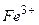 :
:
а) Під час дії жовтої кров’яної солі 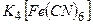 на солі ферум (ІІІ) утворюється синій осад (берлінська лазур):
на солі ферум (ІІІ) утворюється синій осад (берлінська лазур):
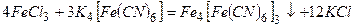
або 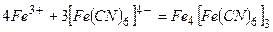
б) Під час взаємодії солі ферум (ІІІ) із амоній роданідом або калій роданідом утворюється сполука темно-червоного кольору:
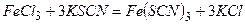
ферум (ІІІ) роданід