Закону, підлягають усі гази незалежно від розмірів їх молекул. Не підлягають йому гази за умов високого тиску та низької температури та речовини в рідкому та газоподібному станах.
Розглянемо, чому закону Авогадро підлягають гази і не підлягають рідкі та тверді речовини.
1. Об'єм, що займає певна кількість речовини в будь-якому агрегатному стані, обумовлюється трьома параметрами: кількістю речовини (числом молекул або інших складових часток - структурних елементів речовини), віддалями між складовими частинами та їх розмірами.
2. У газах за умов низького тиску віддалі між молекулами приблизно в 1000 разів більші за розміри самих молекул, тобто розміри молекул можна не враховувати.
3. Внаслідок цього об'єм газу обумовлюється двома параметрами: числом молекул та відстанями між ними.
4. За однакових умов (тиск та температура) відстані між молекулами в різних газах однакові. Ось чому за однакових умов рівні об'єми різних газів містять одне і те ж число молекул і навпаки. В рідинах та твердих речовинах відстані між частинками мають такий же порядок, як і розміри цих частинок. За низьких температур та під високим тиском відстані між молекулами в газах зменшуються і наближаються до розмірів молекули. Тому за таких умов і гази підлягають закону Авогадро.
На основі закону були визначені молярний об'єм газу за нормальних умов, молекулярні маси та відносні густини газів, стала Авогадро та універсальна газова стала. Закон використовується в розрахунках за хімічними рівняннями.
З закону Авогадро випливає два наслідки.
Перший наслідок:
Один моль будь-якого газу за однакових умов займає однаковий об’єм.
За нормальних умов (при тиску 1 атм., або 101325 Па, та температурі 273,15 К, або 0˚С) об’єм 1 моль будь-якого газу буде дорівнювати 22,4 л. Стала 22,4 л/моль називається молярним об’ємом газу за нормальних умов (н.у.).
Молярний об’єм газу – це величина, що дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу: 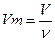
Молярний об’єм газу можна обчислити знаючи молярну масу газу та його густину:
Vm =  ,
,
де Vm – молярний об’єм газу, м3/моль (л/моль),
M – молярна маса газу, кг/моль (г/моль),
ρ – густина газу, кг/м3 (г/л).
Другий наслідок:
Маса того самого об’єму газу тим більша, чим більша маса його молекул. Якщо в однакових об’ємах газів за тих самих умов міститься однакова кількість молекул, то:
а) відношення мас однакових об’ємів газів за тих самих умов дорівнює відношенню їхніх молярних мас:
 ,
,
де m1 і m2 – маси певного об’єму першого та другого газів;
М1 і М2 – молярні маси відповідно першого та другого газів.
б) відношення маси певного газу до маси такого самого об’єму іншого газу (взятих за однакових температури і тиску) називається відносною густиною першого газу за другим:
 або
або 
Тому можна стверджувати, що густини різних газів, що взяті за однакових умов, пропорційні їх молярним масам:

Приклад 12. Яким рівнянням потрібно проводити розрахунки параметрів газів, якщо умови відмінні від нормальних.
Відповідь:
Якщо умови відмінні від нормальних, то при розрахунках параметрів газів використовують рівнянням Клапейрона – Менделєєва:
pV=  RT, де
RT, де
М –мольна маса газу (г/моль);
m – маса газу (г);
T – температура (К);
V – об’єм газу (м3);
p – тиск газу (Па);
R – універсальна газова стала (8,314 Дж/К∙моль).
При розв’язуванні задач з використанням цього рівняння якщо температура подається в С˚, то її треба перевести в К (Т = С˚+273), відповідно переводять тиск в Па (1 атм = 101325 Па, 1 мм. рт. ст. = 133,322 Па).
Приклад 13. Взято дві посудини однакового об’єму. В одну з них вмістили аміак, а в іншу – хлор. Маси газів однакові, тиск також однаковий. Чи однакова температура у посудинах?
Відповідь:
За рівнянням Менделєєва – Клапейрона:
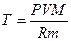 , відрізняються тільки молярні маси газів.
, відрізняються тільки молярні маси газів.
М(NH3) = 17 г/моль
М(Cl2) = 71 г/моль
Поскільки молярна маса хлору більша за молярну масу аміаку, то й температура в посудині з хлором буде більша.
Приклад 14. Визначіть молекулярну масу газу, якщо 0,2 кг його при температурі 67˚С і тискові 4 атм займають об’єм 30,32 л.
| Дано: m = 0,2 кг = 0,2∙103 г Т = 67 + 273 = 340 К Р = 4 атм =4∙101325 Па V =30,32 л=30,32∙10-3м3 | Розв’язання:

 = = 46г/моль = = 46г/моль
|
Знайти: М (газу) -?
Відповідь: молекулярна маса газу дорівнює 46 а.о.м.
Приклад 15. Який об’єм Н2S можна спалити у 800 л повітря? Визначте об’єм сульфур (ІV) оксиду, який одержиться при цьому згорянні.
| Дано: V (повітря)=800л | Розв’язання:
У 800 л повітря міститься 800 ∙ 0,21=168л кисню. Із рівняння реакції:
2H2S + 3O2 = 2H2O + 2SO2
Видно, що для спалювання 2 об’єми H2S потрібно 3 об’єми кисню, тобто:  =112 л =112 л
|
| Знайти: V(H2S) -? |
Відповідь: 112 л H2S
Приклад 16. Який об’єм ацетилену теоретично можна спалити в 1 м3 повітря? Який об’єм СО2 одержується при цьому? Обчисліть зменшення об’єму із врахуванням, що пара конденсується у воду.
| Дано: V (повітря)=1 м3 | Розв’язання:
1. В 1 м3 повітря міститься 0,21 м3 або 210 л кисню.
2. Із рівняння реакції:
2С2Н2 + 5O2 = 4СO2 + 2Н2O
2 об’єми ацетилену згоряє в 5 об’ємах повітря, тобто:  =84 л (С2Н2) =84 л (С2Н2)
|
| Знайти: V(СО2) -? Зменшення об’єму системи -? |
Об’єм СО2, який утворюється, у два рази більший, ніж об’єм ацетилену: 84 ∙ 2 = 168 л
Рівняння реакції показує, що із 7 об’ємів газів одержиться 4 об’єми, тобто проходить зменшення на три об’єми. Об’єм використаних газів: 210 + 84 = 294 л, а зменшення об’єму становить 3/7, тобто 126 л.
Відповідь: 84 л(С2Н2); зменшення об’єму до 126 л.
Приклад 17. Розрахувати масові частки елементів у ортофосфатній кислоті.
Дано:

| Розв’язок:
Визначаємо відносну молярну масу ортофосфатної кислоти та відносні атомні маси Гідрогену, Фосфору і Оксигену:

 ; ;  ; ;  . .
|
Знайти:
 ; ;
 ; ;
 -? -?
|
Обчислюємо масові частки Гідрогену, Фосфору і Оксигену у ортофосфатній кислоті:
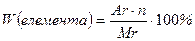 ,
,
де  - число атомів у молекулі.
- число атомів у молекулі.


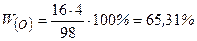
Відповідь: масові частки Гідрогену –3,06%;
Фосфору – 31,63%;
Оксигену. – 65,31%.
Приклад 18. Яку масу мають 30 л азоту при нормальних умовах?
Дано:
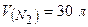
| Розв’язок:
Молярний об’єм газу при нормальних умовах 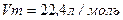 .
Враховуючи це, знаходимо кількість молей азоту: .
Враховуючи це, знаходимо кількість молей азоту:
 (моль)
Молярна маса азоту (моль)
Молярна маса азоту 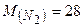 г/моль, тобто 1 моль азоту має масу 28 г. г/моль, тобто 1 моль азоту має масу 28 г.
|
Знайти:
 -? -?
|
Визначаємо масу 1,34 моль азоту:
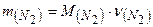
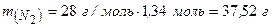
Відповідь: маса 30 л азоту при н. у. 37,52 г.
Приклад 19. Обчислити густину і відносну густину
карбон (IV) оксиду  за воднем і за повітрям.
за воднем і за повітрям.
Дано:

| Розв’язок:
Обчислюємо молярні маси необхідних речовин:
 г/моль г/моль
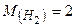 г/моль г/моль
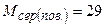 г/моль.
Густину карбон (IV) оксиду г/моль.
Густину карбон (IV) оксиду  обчислюємо за формулою: обчислюємо за формулою:
 ; ;
|
Знайти:
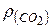

 -? -?
|
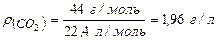
Відносну густину карбон (IV) оксиду  за воднем обчислюємо за формулою:
за воднем обчислюємо за формулою:
 ;
; 
Відносну густину карбон (IV) оксиду  за повітрям обчислюємо за формулою:
за повітрям обчислюємо за формулою:
 ;
; 
Відповідь: густина  дорівнює 1,96 г/л; відносна густина
дорівнює 1,96 г/л; відносна густина  за воднем – 22, за повітрям – 1,5, тобто
за воднем – 22, за повітрям – 1,5, тобто  у 22 рази важчий за водень та в 1,5 рази важчий за повітря.
у 22 рази важчий за водень та в 1,5 рази важчий за повітря.
Приклад 20. Відносна густина газу за повітрям дорівнює 1,517. Обчислити кількість речовини цього газу, що міститься в його зразку масою 11 г.
Дано:


| Розв’язок:
Обчислюємо молярну масу за формулою:

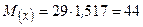 г/моль.
Обчислюємо кількість речовини газу г/моль.
Обчислюємо кількість речовини газу  : :
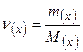
|
Знайти:
 -? -?
|
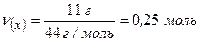
Відповідь: кількість речовини газу  дорівнює 0,25 моль.
дорівнює 0,25 моль.
Приклад 21. Посудина містить водень масою 0,24 г та кисень масою 4 г. Обчисліть об’ємну та молярну частки водню в цій газовій суміші.
Дано:
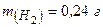

| Розв’язок:
Кількість речовини водню в посудині становить:
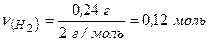 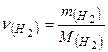 Об’єм водню дорівнює:
Об’єм водню дорівнює: 
|
Знайти:
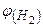
 -? -?
|
де  - молярний об’єм газу за даних умов.
- молярний об’єм газу за даних умов.

Обчислюємо кількість речовини кисню:
 ;
; 
Визначаємо об’єм кисню: 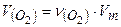 ;
;

Об’єм газової суміші становить:  ;
;
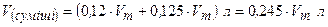
Розраховуємо об’ємну частку водню в суміші:
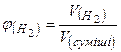 ;
;  або 49%.
або 49%.
Визначаємо молярну частку водню: 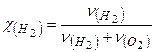 ;
;
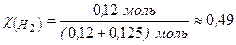 або 49%.
або 49%.
Відповідь: молярна частка газу в газовій суміші дорівнює об’ємній частці цього газу, що випливає із закону Авогадро.






