(Опыт проводят в вытяжном шкафу!) В сухую пробирку помещают 1 каплю смеси жидких алкенов, добавляют 1—2 капли раствора брома и перемешивают смесь. Если желтая окраска не исчезает, то смесь нагревают в пламени горелки до исчезновения окраски. В пробирку вносят синюю лакмусовую бумагу, предварительно смоченную водой. Цвет лакмусовой бумаги не изменяется. Раствор аммиака, внесенный на стеклянной палочке в пробирку, не вызывает образования белого дыма. Химизм процесса:
СНз—С=СН—СНз + Br2  СНз—СВr—СНВr—СНз
СНз—СВr—СНВr—СНз
│ │
СНз СН3
2-метил-2-бутен 2,3-дибром-2-метилбутан
Присоединение брома по месту двойной связи идет по электрофильному механизму с образованием промежуточного комплекса.
Опыт 5. Окисление непредельных углеводородов
В пробирку вводят 1 каплю жидкого алкена, 1 каплю раствора углекислого натрия и добавляют при энергичном взбалтывании 2—3 капли раствора марганцевокислого калия. Фиолетовый цвет исчезает и появляется коричневая окраска от образовавшейся двуокиси марганца:
ОН ОН
│ │
СНз—С=СН-СНз + [О] + Н2O  СНз—С—СН—СНз
СНз—С—СН—СНз
│ │ 
СНз СНз
2 - метил -2,3- бутандиол
Реакция окисления алкенов марганцевокислым калием в нейтральном или щелочном водных растворах служит качественной реакцией на двойную связь. В более жестких условиях— в кислой среде и при нагревании — происходит расщепление молекулы по месту двойной связи. По продуктам окисления устанавливают структуру алкена и положение двойной связи.
Действие концентрированной серной кислоты на непредельные углеводороды
В пробирку помещают 2 капли жидкого алкена и 2 капли серной кислоты. Содержимое пробирки хорошо перемешивают в течение 1—2 мин, охлаждая пробирку проточной водой. Смесь разогревается, слой алкена исчезает.
Химизм процесса:
O-SO3H
│
СНз-С=СН-СНз + НО-SOзН  СНз-С-СН2-СНз
СНз-С-СН2-СНз
│ │ 
CH3 CH3
2-метил-2-бутен изоамилсерная кислота
Серная кислота взаимодействует с алкенами с образованием алкилсерных кислот. Эту реакцию применяют в газовом анализе для выделения газообразных алкенов из их смеси с другими газами и для получения спиртов.
Действие концентрированной азотной кислоты на непредельные углеводороды
В пробирку помещают 2 капли исследуемого алкена и добавляют 2 капли азотной кислоты. Содержимое пробирки встряхивают в течение минуты. Смесь разогревается и буреет. В результате реакции образуется сложная смесь, содержащая смолообразные продукты.
Алкены способны также присоединять высшие окислы азота и хлористый нитрозил C1NO с образованием нитрозитов и нитрозохлоридов:

КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие связи имеются в молекулах алкенов?
2. Почему алкены способны к реакциям присоединения, а алканы нет?
3. Что такое пространственная или геометрическая изомерия?
4. Почему цис- и транс изомеры не могут быть у алк-1-енов?
5. Какой класс углеводородов изомерен с алкенами? Чем отличаются по структуре и по химическим свойствам эти соединения?
6. Дайте трактовку правилу Зайцева исходя из теории индукционного эффекта.
7. Дайте трактовку правилу Марковникова исходя из теории индукционного эффекта.
8. Что является определяющим фактором в образовании продуктов реакции присоединения? Как можно химическим способом определить положение двойной связи в молекуле алкена?
9. Как влияет кислотность среды на механизм реакций окисления алкенов перманганатом калия? Приведите примеры.
ЛАБОРАТОРНАЯ РАБОТА № 4
Тема: АЛКИНЫ
Цель работы: Изучить методы получения и свойства алкинов.
Оборудование и реактивы: карбид кальция (кусочки), насыщенная бромная вода, 1-%-ный раствор перманганата калия. 10%-ный раствор карбоната натрия, 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака, аммиачный раствор хлорида меди (I) газоотводные трубки, прямые газоотводные трубки с оттянутым концом, крышки от тиглей, фильтровальная бумага, пробирки.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Методы получения
Наиболее общим способом получения ацетиленовых углеводородов является действие спиртового раствора щелочей на дигалогенпроизводные предельных углеводородов с вицинальным (а) или геминальным (б) расположением атомов галогена
а) СН2Вг–СН2Вг  СН=CН +2HBr
СН=CН +2HBr
б) СН3-СН2-CНCl2  CH3-C
CH3-C  CH + 2HC1
CH + 2HC1
Так как вицинальные дигалогенпроизводные обычно получают присоединением галогенов к этиленовым углеводородам, то реакцию (а) можно рассматривать как реакцию превращения этиленовых углеводородов в ацетиленовые.
Геминальные дигалогенпроизводные (оба атома галогена у одного атома углерода) являются производными кетонов или альдегидов и, следовательно, с помощью реакций (б) можно осуществить переход от карбонильных соединений к алкинам. При отщеплении галогеноводородов действует правило Зайцева: водород отщепляется от углеродного атома, содержащего меньшее количество атомов водорода.
Ацетилен можно получать непосредственно при высокотемпературном крекинге (термическом или электротермическом) метана или более сложных углеводородов:
2СН4  Н-С
Н-С  С-Н + ЗН2
С-Н + ЗН2
а так же при гидролизе карбида кальция – продукта высокотемпературного взаимодействия оксида кальция и углерода:
СаСО3  СаО + СО2
СаО + СО2
СаО +3С  CаC2 + СО
CаC2 + СО
CаC2 + Н2О  СН
СН  СН + Са(ОН)2
СН + Са(ОН)2
Химические свойства
В молекулах алкинов атом углерода находится в sp -гибридизации, следовательно молекулы алкинов имеют линейное строение, а между атомами углерода имеется тройная –С=С– связь, состоящая из двух 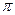 - и одной
- и одной 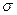 -связи.
-связи.
Все реакции присоединения, свойственные алкенам, наблюдаются и у алкинов. Однако, у алкинов после присоединения первой молекулы реагента остается еще одна 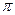 -связь (алкин превратился в алкен), которая снова может вступить в реакцию присоединения второй молекулы реагента.
-связь (алкин превратился в алкен), которая снова может вступить в реакцию присоединения второй молекулы реагента.
Другой особенностью алкинов является наличие у некоторых из них, так называемого, ацетиленового атома водорода ( С-Н).
С-Н). 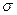 -связь образованная s—орбиталью атома водорода и sp-орбиталью атома С. В орбитали sp по сравнению с орбиталями sp 2 иsp3 доля s -орбитали значительно выше – соответственно 50, 33 и 25%.
-связь образованная s—орбиталью атома водорода и sp-орбиталью атома С. В орбитали sp по сравнению с орбиталями sp 2 иsp3 доля s -орбитали значительно выше – соответственно 50, 33 и 25%.
Так как s-электроны находятся ближе к ядру, чем соответствующие p -электроны, то электроны sp -орбитали значительно прочнее связаны с ядром, чем электроны sp2 и тем более sp3 -орбиталей. Поэтому электронная пара связи  С—Н сильно «оттянута» в сторону атома углерода (
С—Н сильно «оттянута» в сторону атома углерода ( C
C  Н) и следует ожидать более легкого гетеролитического разрыва этой связи с отщеплением протона Н+, т. е. проявления у незамещенных алкинов кислотных свойств.
Н) и следует ожидать более легкого гетеролитического разрыва этой связи с отщеплением протона Н+, т. е. проявления у незамещенных алкинов кислотных свойств.
Это действительно происходит, хотя и в значительно меньшей степени, чем для кислот обычного типа. Поэтому для алкинов, имеющих ацетиленовый атом водорода, следует помимо реакций присоединения по тройной связи ожидать и реакций замещения этого атома водорода на другие группы,
А. Реакции присоединения
1. Присоединение водорода. При последовательном присоединении одной молекулы водорода к тройной связи получается соответствующий алкен, а в последствии и алкан:
НС  СН + H2
СН + H2  H2C=CH2 + H2
H2C=CH2 + H2  H3C-CH3
H3C-CH3
Реакция легко идет над катализаторами (Рd, Pt или Ni).
2. Присоединение галогенов. Галогены также присоединяются к тройной связи с образованием или двузамещенного галогенпроизводного этиленового углеводорода (присоединение одной молекулы галогена), или четырехзамещенных галогенпроизводных алкана.
СН3-С  СН
СН 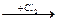 CH3-CCl=CHCl
CH3-CCl=CHCl 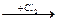 CH3-CCl2-CCl2
CH3-CCl2-CCl2
3. Присоединение галогеноводородов. Присоединение одной молекулы галогеноводорода к алкинам приводит к образованию моногалогенпроизводных алкенов. Присоединение второй молекулы галогеноводорода приводит к образованию геминальных дигалогенпроизводных алканов (в соответствии с правилом Марковникова):
НС  СН
СН 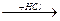 H2C=CHCl
H2C=CHCl 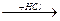 H3C-CHCl2
H3C-CHCl2
4. Присоединение воды. Вода присоединяется к ацетиленовым углеводородам под действием разных катализаторов, но особенно легко в присутствии солей ртути (II) в сернокислом растворе (Кучеров,1881 год). При этом из ацетилена получается уксусный альдегид, а из гомологов ацетилена - кетоны. На первой стадии присоединение воды происходит в соответствии с правилом Марковникова, с образованием неустойчивого винилового спирта. Последний перегруппировывается в соответствующий кетон (в случае ацетилена - ацетальдегид):
R-C  CH + H2O
CH + H2O  [R-C=CH2]
[R-C=CH2]  R- C-CH3
R- C-CH3
│ ║
 ОН О
ОН О
5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
 R-C
R-C  CH + С2Н5OН
CH + С2Н5OН  R- C = CH2
R- C = CH2
│ 
О-С2Н5
6. Присоединение карбоновых кислот. Уксусная кислота присоединяется к ацетилену в присутствии ортофосфорной кислоты с образованием винилацетата – мономера для синтеза поливинилацетата (ПВА).
НС  СН + НООС-СН3
СН + НООС-СН3 
 Н2С=СН-О-СО-СН3
Н2С=СН-О-СО-СН3
7. Присоединение синильной кислоты. При совместном каталитическом действии Сu2Cl2 и NH3 к ацетилену можно присоединить синильную кислоту с образованием акрилонитрила, применяющегося в производстве синтетических каучуков:
НС  СН + HCN
СН + HCN  H2C=CH-C
H2C=CH-C  N
N
8. Реакции димеризации и тримеризации. При каталитической димеризации ацетилена (Сu2Cl2 и NH4Cl) образуется винилацетилен, а при тримеризации – бензол.
2НС  СН
СН  НС
НС  С-СН=СН2; 3НС
С-СН=СН2; 3НС  СН
СН  C6H6
C6H6
Б. Реакции ацетиленового атома водорода
При соответствующих условиях атом водорода, находящийся у тройной связи, способен замещаться на атомы металлов. При этом образуются ацетилениды соответствующих металлов:
R-C  CH + NaNH2
CH + NaNH2  R-C
R-C  C-Na + NH3
C-Na + NH3
R-C  CH + [Ag(NH3)2]OH
CH + [Ag(NH3)2]OH  R-C
R-C  C-Аg + H2O + 2NH3
C-Аg + H2O + 2NH3
Действием алкилгалогенидов на ацетилениды могут быть синтезированы одно- и двузамещенные ацетилены:
R1-C  C-Na + R2-Br
C-Na + R2-Br  R1-C
R1-C  C-R2 + NaBr
C-R2 + NaBr
HC  C-Ag + R-Br
C-Ag + R-Br  HC
HC  C-R + AgBr
C-R + AgBr
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
4.2.1 Получение ацетилена и его горение (тяга). В пробирку помещают небольшой кусочек карбида кальция СаС2, и приливают 1мл воды. Пробирку сразу же закрывают пробкой с газоотводной трубкой с оттянутым концом. Выделяющийся ацетилен поджигают. Он горит коптящим пламенем (на поднесенной к пламени крышке тигля образуется пятно сажи). При интенсивной подаче кислорода ацетилен горит светящимся пламенем, так как происходит его полное сгорание. Напишите химизм процесса получения ацетилена и реакции неполного (с образованием сажи) и полного сгорания ацетилена.
4.2.2 Взаимодействие ацетилена с бромной водой. Пробирку с карбидом кальция и водой закрывают пробкой с изогнутой газоотводной трубкой и пропускают ацетилен через насыщенную бромную воду. Наблюдают постепенное обесцвечивание бромной воды. Напишите уравнения реакций присоединения брома к ацетилену по стадиям, с промежуточным образованием дибромалкена. Объясните, почему ацетилен обесцвечивает бромную воду значительно медленнее, чем этилен?
4.2.3 Реакция окисления ацетилена пepманганатом калия. В пробиркy наливают 1 мл раствора перманганата калия, добавляют 1 мл 10%-ного раствора карбоната натрия, а затем, через полученный раствор пропускают ацетилен. Фиолетовая окраска исчезает и появляется хлопьевидный осадок оксида марганца (IV) бурого цвета. Напишите уравнение реакции, методами полуреакций и электронного баланса, расставьте коэффициенты.
4.2.4 Получение ацетиленидов серебра и меди. Для получения ацетиленида серебра в пробирку наливают 2 мл 1%-ного раствора нитрата серебра и прибавляют по каплям 5%-ный раствор аммиака до полного растворения образующегося осадка оксида серебра. Через полученный раствор пропускают ацетилен и наблюдают выпадение желтовато-серого осадка ацетиленида серебра.
Осадок отфильтровывают и просушивают между листами фильтровальной бумаги. При нагревании ацетиленид серебра взрывается.
Для получения ацетиленида меди (I) через аммиачный раствор хлорида меди (I) пропускают ацетилен. Раствор сначала окрашивается в красный цвет (цвет оксида меди), а затем выпадает красно-бурый осадок ацетиленида меди (I). Эту реакцию можно применять при обнаружении следов ацетилена в помещениях и при санитарной экспертизе воздуха на предприятиях.
Если смоченную аммиачным раствором мокрую полоску бумаги подносить к отверстию пробирки, из которой выделяется ацетилен, то наблюдается красно-бурое окрашивание бумаги.
Напишите соответствующие уравнения химических реакций образования ацетиленидов серебра и меди (I).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем отличаются вицинальные дигалогенпроизводные алканов от геминальных?
2. Что общего в строении и химических свойствах между алканами и алкинами?
3. Чем отличаются по строению и химическим свойствам алканы и алкины?
4. Почему при гидрогалогенировании алкинов образуются геминальные дигалогенпроизводные алканов?
5. Почему ацетиленовый атом водорода обладает кислотными свойствами?
6. Приведите примеры реакций с участием кислого атома водорода ацетиленовой группы.
7. Почему при реакции Кучерова в случае ацетилена образуется ацетальдегид, а в случаях с гомологами ацетилена - кетоны? Напишите уравнение химической реакции присоединения воды к метилэтилацетилену.
8. Как можно обнаружить следы ацетиленовых соединений в производственных помещениях? Напишите уравнение химической реакции.
9. Исходя из соответствующих ацетиленидов серебра напишите схему синтеза метилизопропил- и дипропилацетиленов.
10. Почему у алкинов, в отличие от алканов, не существует геометрическая изомерия?
11. Какие классы соединений изомерны с алкинами? На примере соединения С4Н6 покажите явление межклассовой изомерии углеводородов.
12. Напишите все изомеры соединения С5Н8.
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема: АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Цель работы: Изучить основные способы получения и химические свойства ароматических углеводородов.
Оборудование и реактивы: бензол, толуол, 5-процентный раствор перманганата калия, 2 н. раствор серной кислоты, бром, четыреххлористый углерод, железные опилки, раствор аммиака, 2 н., раствор карбоната натрия, прокаленный хлорид кальция, этиловый спирт, нитробензол, концентрированные кислоты (азотная, серная), цитрат аммония, хлорид кальция, ксилол, стаканы химические на 50 мл, бензол (обезвоженный), хлороформ (обезвоженный), безводный хлорид алюминия.: пробка с обратным воздушным холодильником: синяя лакмусовая бумага, круглодонная колба на 25 мл, термометр, пробирка с пробкой с нисходящий газоотводной трубкой, часовое стекло, стеклянная трубка,круглодонная колба на 25 мл, силуфоловая пластинка
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Методы получения
В значительном количестве углеводороды ряда бензола содержатся в некоторых сортах нефти, откуда их и получают при переработке нефти. Помимо этого, так как ядро бензола энергетически очень «выгодная» система, соединения ароматического ряда образуются при многих процессах. Так, например, при каталитическом и термическом крекинге нефти, даже не содержащих ароматических соединений, они образуются в заметном количестве вследствие превращений других углеводородов.
При переработке каменного угля в кокс в отгоняющемся каменноугольном дегте содержание соединений ароматического ряда достигает нескольких десятков процентов.
В лабораторной практике и в промышленности для синтеза замещенных аренов широко применяется синтез Фриделя — Крафтса (реакции алкилирования ароматических углеводородов в присутствии кислот Льюиса).
Химические свойства
Особенности ароматических соединений. Бензол является первым представителем ароматических углеводородов. Он обладает рядом своеобразных свойств, отличающих его от изученных ранее предельных и непредельных ациклических углеводородов. Ароматический характер бензола определяется его строением и проявляется в химических свойствах.
Состав бензола выражается формулой C6H6. Общая формула гомологов ряда бензола CnH2n-6. Разность между этой формулой и формулой ряда предельных углеводородов CnH2n+2 равна 8Н. Следовательно, по химическому составу бензол и его гомологи являются непредельными соединениями. Их непредельный характер не проявляется в типичных реакциях. Можно было бы ожидать, что бензол будет вести себя подобно этилену, бутадиену и другим типичным непредельным углеводородам. Однако, он не обесцвечивает бромную воду, т. е. в обычных условиях не присоединяет бром. Раствор марганцевокислого калия при взбалтывании с бензолом не обесцвечивается, т. е. бензол устойчив в этих условиях к окислению. Даже при длительном кипячении с раствором КМn04 бензол почти не окисляется. Для него, в основном, характерны реакции замещения:
а) В присутствии катализаторов — кислот Льюиса (FeCl3, АlСl3) хлор и бром замещают атомы водорода в молекуле бензола:

б) Концентрированная серная кислота не вызывает полимеризации бензола, как это происходит в случае алкадиенов, а приводит к получению бензолсульфокислоты:

в) При действии нитрующей смеси (концентрированные НNO3 и H2SO4) происходит нитрование ядра (введение в ядро нитрогруппы -NO2) с образованием нитропроизводных бензола.

нитробензол
Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
1. Радикальное замещение. Если атакующий агент R• – радикал, несущий неспаренный электрон, то водород, связанный с атомом углерода ядра, отщепляется с одним из электронов электронной пары 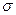 -связи. Такой тип замещения называется радикальным. Реакция радикального замещения редко используется в ароматическом ряду.
-связи. Такой тип замещения называется радикальным. Реакция радикального замещения редко используется в ароматическом ряду.
R• + Н-С6Н5  R-С6Н5 + Н•
R-С6Н5 + Н•
2. Нуклеофильное замещение. При действии несущих отрицательный заряд нуклеофильных частиц на замещенный бензол С6Н5Х (где Х – заместитель), отщепляющаяся группа Х- уходит вместе с парой 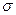 -электронов, ранее осуществлявших ее связь с ядром:
-электронов, ранее осуществлявших ее связь с ядром:
Z- + X: C6H5  Z-C6H5 + X-
Z-C6H5 + X-
Примером может служить реакция взаимодействия натриевой соли бензолсульфокислоты со щелочью. Эта реакция лежит в основе промышленного метода получения фенола:
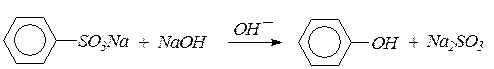
Как правило, для успешного протекания реакций нуклеофильного замещения в ядре должен находиться дополнительно один или лучше два сильных электроноакцепторных заместителя (–NO2, –SO3Н, –СF3).
3. Электрофильное замещение.
Z+ + X:C6H5  Z-C6H5 + X+
Z-C6H5 + X+
Во всех реакциях этого типа атакующий реагент (Y+) несет на атоме, вступающем в связь с углеродным атомом бензольного ядра, положительный заряд либо имеет ярко выраженный катионоидный характер и образует новую связь за счет пары электронов, ранее осуществлявшей связь С-Н. Замещающийся атом водорода уходит в виде протона (Н+).

Реакции присоединения к бензолу. В отдельных редких случаях бензол способен к реакциям присоединения. Гидрирование, т. е. присоединение водорода, происходит при действии водорода в жестких условиях в присутствии катализаторов (Ni, Pt, Pd). При этом молекула бензола присоединяет три молекулы водорода с образованием циклогексана:

циклогексан
Если раствор хлора или брома в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит радикальное присоединение трех молекул галогена с образованием сложной смеси стереоизомеров гексахлорциклогексана (гексахлорана):
|
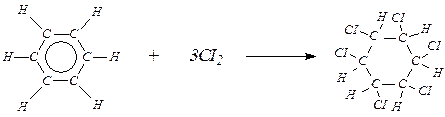
Таким образом, ароматический характер бензола (и других аренов) выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение; для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя как триеновый углеводород.
5.2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ






