ОРГАНИЧЕСКАЯ
Х И М И Я
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ №1-№11
для студентов 2-го курса направления подготовки бакалавров 270800 «Строительство» (профиль 270106 – Производство строительных материалов, изделий и конструкций)
БРЯНСК 2013
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Брянская государственная инженерно-технологическая академия»
Кафедра химии
УТВЕРЖДЕНО
Научно-методическим советом БГИТА
Протокол№____от_________2013г
ОРГАНИЧЕСКАЯ
Х И М И Я
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ №1-№11
для студентов 2-го курса направления подготовки бакалавров 270800 «Строительство» (профиль 270106 – Производство строительных материалов, изделий и конструкций)
БРЯНСК 2013
УДК: 542.2.9
Органическая химия: методические указания по выполнению лабораторных работ №1-№11 для студентов 2-го курса направления подготовки бакалавров 270800 «Строительство» (профиль 270106 – Производство строительных материалов, изделий и конструкций) / Брянск. гос. технол акад. сост. О.С. Винникова, Л.А. Сильченко. – Брянск БГИТА, 2013. – 92с.
В предлагаемых методических указаниях авторы попытались кратко изложить теоретические основы органической химии на примере основных классов органических соединений. Теоретические вопросы излагаются на основе бутлеровских представлений о взаимном влиянии атомов в молекулах и современных квантово-механических воззрений. Методические указания содержат перечень контрольных вопросов, что, по мнению авторов, должно способствовать эффективному закреплению теоретических знаний полученных студентами по курсу органической химии.
Рецензент:
к. х. н., доцент каф. БЖДиХ БГТУ Казаков О.Г.
Рекомендованы редакционно-издательской и методической комиссиями строительного факультета БГИТА
Протокол № _____ от «____»___________ 2013г.
Введение
Изучение основ органической химии имеет большое теоретическое и практическое значение. Продукты органического синтеза применяются как сырье и вспомогательные материалы во всех отраслях промышленности, в том числе и в строительстве. Так, в современной строительной индустрии находят применение различные пластмассы, используются всевозможные органические добавки в цементы и бетоны, создаются новые лаки, клеи и герметики, пропиточные гидрофобизирующие составы и др. Это позволяет постепенно заменять традиционные строительные материалы более легкими, красивыми и прочными современными материалами.
Задача химизации строительства требует от будущих специалистов по производству строительных материалов углубленного изучения курса органической химии.
Данные методические указания содержат теоретический материал для самостоятельной подготовки студентов к лабораторным занятиям, на которых они выполняют задачи по синтезу основных классов органических соединений и полимеров, наиболее широко применяемых в строительстве, а также проводят опыты по определению их физико-химических свойств, что обеспечивает большую результативность усвоения курса органической химии.
ЛАБОРАТОРНАЯ РАБОТА № 1
Тема: МЕТОДЫ ОЧИСТКИ И ВЫДЕЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: ознакомиться с методами очистки и выделения органических соединений.
Оборудование и реактивы: колба Бунзена, воронка Бюхнера, фильтровальная бумага, химические стаканы на 100 мл, стеклянные палочки, электроплитка, фарфоровые чашки, воронки, холодильник Либиха, алонж, колба Вюрца, термометр, конические колбы на 100 мл, штативы, делительная воронка, загрязненная бензойная кислота, загрязненная сорбиновая кислота, жидкость для перегонки (загрязненный ацетон или спирт), диэтиловый эфир, анилин.
Общая характеристика методов очистки и выделения органических соединений
Для установления строения органического соединения (т.е. его идентификации) его необходимо получить в чистом виде. Выделение и очистка органических соединений осуществляются различными методами, наиболее употребимыми среди которых являются кристаллизация (перекристаллизация), возгонка (сублимация), фильтрование, центрифугирование, различные виды перегонки, экстракция, хроматографические методы.
1. Перекристаллизация и дробная кристаллизация применяются для очистки твердых веществ. Кристаллизация включает растворение смеси при высокой температуре в растворителе или смеси растворителей. При охлаждении выкристаллизовывается тот компонент (или компоненты) смеси, который наименее растворим в используемом растворителе или смеси растворителей при низкой температуре.
2. Возгонка (сублимация) используется в случае твердых веществ, которые не плавятся, а переходят непосредственно в пар, а при охлаждении кристаллизуются.
3. Фильтрование позволяет отделить суспендированный в жидкости осадок.
4. Центрифугированием удаляют из жидкости твердые частицы. Под действием центробежных сил, значительно больших, чем сила тяжести, твердые частицы оседают на дно сосуда, после чего жидкость можно слить (декантировать).
5. Перегонка применяется для очистки жидкостей и заключается в постепенном переходе жидкой смеси веществ в газовую фазу с последующей конденсацией паров. Перегонку можно проводить при нормальном или пониженном давлении (вакуум-перегонка). При выделении или очистке нерастворимых или труднорастворимых в воде соединений прибегают к перегонке с водяным паром. С помощью перегонки можно отделять друг от друга компоненты смеси, достаточно различающиеся по температурам кипения. Если при перегонке нет фракций, говорят о простой перегонке. Если же наблюдаются отдельные фракции, перегоняющиеся в определенных температурных интервалах, перегонка называется дробной (фракционной).
6. Экстракцию проводят, действуя растворителем на размельченный твердый материал. Растворившийся компонент выделяют с помощью выпаривания. Экстракцию жидких веществ осуществляют, используя растворитель, не смешивающийся с экстрагируемой жидкостью.
7. Хроматографические методы включают, прежде всего, простертую адсорбционную колоночную хроматографию, впервые используемую Цветом в 1903г. для разделения растительных красителей. При хроматографировании различают стационарную фазу (растворитель или адсорбент) и подвижную фазу (растворитель, элюент или газ-носитель), между которыми происходит распределение исследуемой смеси, вследствие различной растворимости или адсорбционной способности. По физическим принципам хроматографические методы делятся на распределительные (разделение смеси между двумя растворителями), адсорбционные (разделение между растворителем и адсорбентом), вытеснительные (вытеснение вещества, захваченного адсорбентом, другим веществом). На химическом принципе основана афинная хроматография, используемая для выделения сложных биохимических соединений. На практике часто используют совместно разные методы. По используемой методике различают хроматографию колоночную, хроматографию на бумаге, тонкослойную хроматографию, газовую, жидкостную, ионообменную, на молекулярных ситах или на гелях (гельфильтрация).
Кристаллизация
Теоретическая часть
Кристаллизация (перекристаллизация) используется для разделения смеси твердых веществ, а также их очистки от различных загрязнений. По сравнению с другими методами она наиболее универсальна, относительно мало трудоемка, обеспечивает при правильном проведении высокую степень очистки, хотя и связана иногда со значительными потерями очищаемого продукта.
Перекристаллизации основана на различной растворимости вещества в горячем и холодном растворителе и включает следующие этапы:
· выбор растворителя;
· предварительное удаление примесей;
· приготовление горячего насыщенного раствора;
· отделение не растворившихся примесей, обработка раствора адсорбентом, отделение от адсорбента;
· охлаждение раствора;
· отделение образовавшихся кристаллов;
· промывка, кристаллов чистым растворителем;
· сушка.
Выбор растворителя. Успех перекристаллизации определяется, прежде всего, правильным выбором растворителя. Растворитель должен отвечать следующим требованиям:
· хорошо растворять очищаемое соединение при нагревании и плохо на холоду;
· примеси либо вообще не должны растворяться, либо обладать высокой растворимостью даже на холоду;
· быть инертным по отношению к растворяемому веществу;
· отличаться доступностью, малой токсичностью, наименьшей опасностью в пожарном отношении;
· качество перекристаллизации зависит от чистоты растворителя, поэтому применение технических, неочищенных растворителей по возможности исключается.
Приготовление насыщенного горячего раствора. Если растворимость очищаемого вещества неизвестна, ее приблизительно определяют, растворяя небольшую навеску в пробирке. Затем, пользуясь результатами определения, к отвешенному количеству очищаемого вещества приливают несколько меньшее, чем требуется для образования: насыщенного раствора, количество растворителя. Смесь при непрерывном перемешивании стеклянной палочкой доводят до кипения (в химическом стакане или колбе на электроплитке в. случае, если растворитель - вода) и затем приливают воду небольшими порциями, каждый раз возобновляя кипение, до тех пор, пока вещество полностью не растворится. В некоторых случаях изменяют порядок растворения.
Если образовавшийся раствор содержит муть, его фильтруют, разбавляя небольшим количеством горячей воды или пользуясь воронкой для горячего фильтрования во избежание кристаллизации вещества на фильтре.
Растворение в органических растворителях подлежащих кристаллизации веществ проводят в колбе, снабженной обратным холодильником.
Горячее фильтрование насыщенного раствора в органическом растворителе - ответственная операция, для выполнения которой необходим некоторый опыт и предельная пунктуальность, так как органический горячий растворитель пожароопасен.
Удаление примесей и очистка растворов. Перекристаллизация продуктов с содержанием основного вещества менее 95% осуществляется путем предварительного удаления примесей с помощью адсорбентов. Для этого растертый в порошок адсорбент (обычно активированный уголь) небольшими порциями присыпают к насыщенному горячему раствору, удалив источник нагрева (иначе возможно бурное вскипание жидкости и выброс ее из стакана или колбы). Чтобы адсорбция прошла полнее, раствор некоторое время кипятят с углем, затем проводят горячее фильтрование через плотный фильтр, например, бумагу "синяя лента". Количество адсорбента составляет обычно 0,5-2% от массы очищаемого вещества. Даже однократная обработка адсорбентами нередко может заменить несколько перекристаллизации. Выигрыш во времени и в отношении выхода чистого продукта делает эту операцию, несомненно, целесообразной.
К рекомендуемым способам предварительного удаления примесей относится также промывка очищаемого продукта растворителем, в котором основное вещество нерастворимо или плохо растворимо, а примеси хорошо растворимы.
Осаждение кристаллов из раствора. Для получения возможно более чистого продукта горячий насыщенный раствор подвергают медленному охлаждению. Слишком быстрое охлаждение вредит очистке, так как приводит к образований мелких кристаллов. Особой тщательности требует работа с веществами, склонными к образованию пересыщенных растворов. При охлаждении растворов таких веществ, кристаллы долго не выделяются из-за отсутствия центров кристаллизации. Один из способов стимулирования кристаллизации - "введение затравки", т.е. внесение в охлаждаемый насыщенный раствор нескольких чистых кристаллов подвергаемого перекристаллизации вещества. Кристаллизацию вызывает также интенсивное потирание стеклянной палочкой о внутренние стенки сосуда с насыщенным раствором очищаемого вещества.
После окончания кристаллизации выпавший продукт отфильтровывают на воронке Бюхнера с отсасыванием. Кристаллы тщательно промывают на фильтре небольшими порциями холодного чистого растворителя, не смешивая промывную жидкость с маточным раствором. Назначение промывки не только в отделении маточного раствора, но и в удалении адсорбированных на поверхности кристаллов примесей.
Выделенный кристаллический продукт после фильтрования и промывки подвергают сушке.
Экспериментальная часть
Кристаллизация бензойной кислоты. Небольшое количество (около 1 г) загрязненной бензойной кислоты растворяют в 30—50 мл кипящей воды в открытой колбе или химическом стакане. Полученный горячий раствор быстро фильтруют через складчатый фильтр, помещенный в стеклянную воронку. Собранный в стакан или коническую колбу фильтрат охлаждают ледяной водой при перемешивании. Выделяются белые кристаллы бензойной кислоты. Через 30 мин осадок отфильтровывают на воронке Бюхнера (см. рис. 1) с использованием водоструйного насоса и сушат при 600 С, Тпл =122°С.
Возгонка (сублимация)
Теоретическая часть
Возгонка, или сублимация, связана с переходом кристаллического вещества, нагретого ниже его температуры плавления, в парообразное состояние (минуя жидкую фазу), а затем при охлаждении — опять в твердое состояние. Этим способом хорошо очищаются вещества, если летучесть сопутствующих загрязнений отличается от летучести основного вещества. Возгонкой можно хорошо очистить бензойную кислоту, антрацен, нафталин, йод, серу и др.
Возгонку можно проводить при нормальном и пониженном давлении,
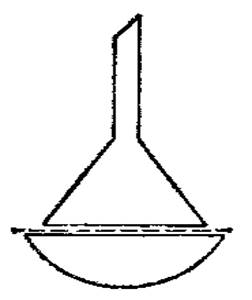 Для возгонки веществ при нормальном давлении вещество помещают в фарфоровую чашку, которую накрывают перевернутой стеклянной воронкой (рис.2). Отводную трубку воронки закрывают куском ваты. Между чашкой и воронкой помещают фильтровальную бумагу с небольшими отверстиями во многих местах для пропускания паров. Это делают для того, чтобы кристаллы вещества, образовавшиеся на холодной поверхности воронки, не падали опять на возгоняемое вещество. Воронку охлаждают, прикладывая к наружной поверхности смоченный в воде кусок ткани.
Для возгонки веществ при нормальном давлении вещество помещают в фарфоровую чашку, которую накрывают перевернутой стеклянной воронкой (рис.2). Отводную трубку воронки закрывают куском ваты. Между чашкой и воронкой помещают фильтровальную бумагу с небольшими отверстиями во многих местах для пропускания паров. Это делают для того, чтобы кристаллы вещества, образовавшиеся на холодной поверхности воронки, не падали опять на возгоняемое вещество. Воронку охлаждают, прикладывая к наружной поверхности смоченный в воде кусок ткани.
|
Экспериментальная часть
Очистка нафталина возгонкой. Около 1 г технического нафталина помещают в маленькую фарфоровую чашку и накрывают стеклянной воронкой. Чашку слабо нагревают, не допуская плавления вещества. При этом нафталин возгоняется и оседает в виде игл на стенках воронки. Все ли твердые вещества можно очищать подобным методом?
Перегонка
Теоретическая часть
Перегонка—процесс отделения жидких веществ от нелетучих примесей или разделения летучих веществ с различной температурой кипения. Это достигается нагреванием жидкости до кипения и последующей конденсацией ее паров в холодильнике.
Существуют три способа перегонки жидкости:
а) при нормальном давлении (простая и фракционная перегонка);
б) при пониженном давлении (перегонка в вакууме);
в) с водяным паром.
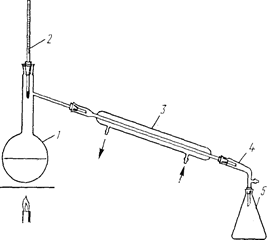 Перегонка при нормальном давлении (простая перегонка). Этот способ применяют, если разница в температурах кипения веществ, входящих в состав разделяемой смеси, не менее 80-100 °С или если основное вещество необходимо отделить от нелетучих примесей.
Перегонка при нормальном давлении (простая перегонка). Этот способ применяют, если разница в температурах кипения веществ, входящих в состав разделяемой смеси, не менее 80-100 °С или если основное вещество необходимо отделить от нелетучих примесей.
|
Если температура кипения перегоняемой жидкости не выше 120-130 °С, то применяют проточное водяное охлаждение. При перегонке жидкостей с более высокой температурой кипения рекомендуется использовать в качестве охлаждающего компонента непроточную воду (т. е. воду, которая осталась в холодильнике после прекращения ее подачи) или применять воздушный холодильник. Чтобы жидкость кипела равномерно, в колбу помещают кусочки обожженного неглазурованного фарфора или длинные стеклянные капилляры, запаянные с одного конца и погруженные в жидкости Другим конном. Скорость перегонки регулируется скоростью поступления жидкости в приемник (не более 1-2 капель в секунду).
При перегонке индивидуального вещества его температура кипения остается постоянной в течение всей перегонки. Если перегоняется смесь двух веществ, температуры кипения которых различаются значительно, то вначале отгоняется жидкость с более низкой температурой кипения. Если температура кипения начинает возрастать, это означает, что начинает перегоняться другая жидкость, имеющая более высокую температуру кипения, чем первая. В процессе перегонки второй жидкости также устанавливается постоянная температура. Таким образом, меняя приемники, можно собрать несколько фракций; в первых будет преобладать низкокипящая часть перегоняемой смеси, а в последних – высококипящая.
Если перегоняемая смесь состоит из компонентов, температуры, кипения которых близки и которые не образуют азеотропных смесей, применяют дробную, или фракционную, перегонку. Для этого обычно используют дефлегматоры и ректификационные колонки. В них часть паров перегоняемой смеси конденсируется (за счет охлаждения наружным воздухом), превращаясь и жидкость, обогащенную сравнительно высококипящим компонентом. Оставшийся пар, наоборот, обогащается более летучей частью смеси. Таким образом, пары, проходящие через колонку, богаче летучим компонентом, чем пары, находящиеся над перегоняемой жидкостью. Жидкость (конденсат), стекающая в колбу, наоборот, содержит высококипящие вещества.
Если температура кипения перегоняемых жидкостей не выше 80 0С (спирт, ацетон, эфир, бензол и др.), то нагревание следует проводить только на водяной бане.
Экспериментальная часть
Очистка спирта. Небольшое количество спирта (около 30 мл), загрязненного любой растворимой примесью (водой, ацетоном, пиридином и др.), очищают методом простой перегонки. Исходя из количеств взятого и очищенного спирта, рассчитайте процентный состав первоначальной смеси. Следует обратить внимание на показание термометра в процессе перегонки. Сохраняется ли оно все время постоянным?
Экстракция
Теоретическая часть
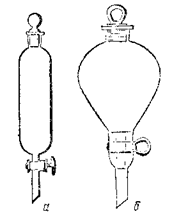
Экстракция, или извлечение, основана на различной растворимости веществ в двух несмешивающихся жидкостях. Чаще всего экстрагированию приходится подвергать водные растворы. Для этого пользуются делительной воронкой (рис. 4.), в которую наливают раствор, содержащий экстрагируемое вещество и экстрагирующую жидкость, т. е. растворитель, в котором эго вещество растворяется лучше. Растворитель для экстракции должен:
1. Мало растворяться в другом растворителе, который содержит экстрагируемое вещество;
2.  Заметно лучше растворять экстрагируемое вещество, чем растворитель, из которого это вещество экстрагируется;
Заметно лучше растворять экстрагируемое вещество, чем растворитель, из которого это вещество экстрагируется;
3. Не должен химически взаимодействовать ни с экстрагируемым веществом, ни с растворителем, в котором оно растворено;
4. Быть сравнительно безопасным;
5. Легко удаляться при выделении из него вещества;
6.  Хорошо растворять целевой продукт и плохо примеси (или наоборот).
Хорошо растворять целевой продукт и плохо примеси (или наоборот).
Делительную воронку, содержащую раствор экстрагируемого вещества и растворитель (не более 2/3 ее объема), закрывают пробкой и осторожно встряхивают, придерживая при этом пробку указательным пальцем. В воронке может повышаться давление за счет испарения растворителя, поэтому нужно периодически открывать кран и выпускать пары растворителя (при этом воронку держат трубкой вверх и в сторону от стоящего рядом товарища). Кран воронки при этом также должен «смотреть» вверх. После встряхивания делительную воронку закрепляют в штативе и оставляют в покое до полного разделения слоев. Затем открывают пробку и, осторожно открывая кран, медленно сливают нижний слой в стакан, стараясь не слить вместе с нижним слоем и верхний. Оставшийся слой (экстракт) выливают через верхнее отверстие воронки в другую посуду и сушат подходящим осушителем. После этого растворитель отгоняют на бане. Обычно это не вызывает никаких затруднений, так как растворители, применяемые для экстракции кипят при сравнительно низких температурах.
Экспериментальная часть
Извлечение диэтиловым эфиром анилина из смеси анилин – вода.
Около 10 мл 3 % суспензии анилина в воде помещают в делительную воронку, приливают 6 мл эфира и встряхивают. Эфирный экстракт анилина после отстаивания будет находиться в верхнем слое, а вода - в нижнем. В дальнейшем поступают так, как описано выше. При проведении опыта поблизости не должно быть открытого огня!
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. К каким параметрам относятся температура кипения и плавления? Какое значение имеют эти параметры и как можно ими пользоваться.
2. Какой вывод можно сделать, если испытуемый образец имеет температуру плавления ниже, чем литературные данные?
3. Какой вывод можно сделать, если экспериментально установлено, что при повторных циклах плавления - охлаждения наблюдается тенденция снижения температуры плавления?
4. Почему значение температуры кипения зависит от уровня расположения ртутного шарика термометра?
5. Как можно установить эффективность процесса перекристаллизации? Каким образом можно догадаться, что дальнейшие циклы перекристаллизации нецелесообразны?
6. Почему загрязненные кристаллические вещества имеют температуру плавления ниже по отношению к чистым? Ответ мотивируйте с позиции коллигативных свойств растворов (криоскопический закон Рауля).
7. Почему при измерении температуры плавления нагревание образца следует осуществлять медленно?
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема: АЛКАНЫ
Цель работы: изучение методов получения и химических свойств алканов.
Оборудование и реактивы: пинцет; стеклянная палочкагазоотводная трубка, уксуснокислый натрий, обезвоженный; натронная известь; бромная вода, насыщенный раствор; марганцево-кислый калий, 1 н. раствор; жидкие алканы; раствор брома в органическом растворителе; аммиак, 25%-ный раствор; лакмусовая бумага синяя; жидкие алканы; марганцовокислый калий, 1 н. раствор; углекислый натрий, 1 н. раствор; жидкие алканы; серная кислота концентрированная (d == 1,84 г/см3); азотная кислота (d = 1,4 г/см3).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Методы получения
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда — природный газ. Однако, выделение индивидуальных соединений из нефти или продуктов ее крекинга — весьма трудоемкая, а часто и невыполнимая задача, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы образуются при действии металлического натрия на моногало-генпроизводные – реакция Вюрца:
H3C-CH2-Br + Br-CH2-CH3 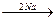 CН3-CН2–CН2-CH3 + 2NaBr
CН3-CН2–CН2-CH3 + 2NaBr
Если взяты разные галогенпроизводные, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе одинаковых или разных молекул равна, а реакционная способность их близка:
3С2Н5I + 3CH3CH2CH2I 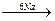 C4H10 + C5H12 + C6H14 + 6NaI
C4H10 + C5H12 + C6H14 + 6NaI
2. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов.
НзС-СН=СН-СН3 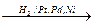 НзС-СН2–СН2-СН3
НзС-СН2–СН2-СН3
3. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре йодоводородной кислотой:
(CH3)2CHBr + 2HI  (CH3)2CH2 + HBr + I2
(CH3)2CH2 + HBr + I2
4. Алканы могут быть полученыпри сплавлении солей карбоновых кислот со щелочью. Образующийся при этом алкан содержит на один атом углерода меньше, чем исходная карбоновая кислота:
CH3-COONa + NaOH 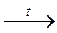 CH4 + Na2CO3
CH4 + Na2CO3
Химические свойства
Предельные углеводороды при обычных условиях обладают большой химической инертностью. Это объясняется тем, что все 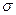 -связи углерод — углерод и углерод — водород в них весьма прочны (энергии этих связей порядка 350-400 кДж/моль). К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. C большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Так, концентрированная серная кислота, обугливающая многие органические соединения, на предельные углеводороды не действует при комнатной температуре. Сильные окислители (например, перманганат калия) при комнатной температуре тоже не действуют на алканы.
-связи углерод — углерод и углерод — водород в них весьма прочны (энергии этих связей порядка 350-400 кДж/моль). К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. C большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Так, концентрированная серная кислота, обугливающая многие органические соединения, на предельные углеводороды не действует при комнатной температуре. Сильные окислители (например, перманганат калия) при комнатной температуре тоже не действуют на алканы.
1. Радикальное галогенирование. На свету галогены (энергичнее всего хлор, с йодом реакция не идет) последовательно замещают атомы водорода в предельных углеводородах:
CH4 + Cl2 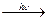 CH3Cl + HCl
CH3Cl + HCl
CH3Cl + Cl2 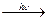 CH2Cl2 + HCl
CH2Cl2 + HCl
CH2Cl2 + Cl2 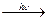 CHCl3 + HCl
CHCl3 + HCl
CHCl3 + Cl2 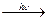 CCl4 + HCl
CCl4 + HCl

 Механизм этой реакции сложен. На первой стадии под влиянием света происходит гомолитический разрыв связи в молекуле хлора, и она распадается на два радикала: Сl2 + h
Механизм этой реакции сложен. На первой стадии под влиянием света происходит гомолитический разрыв связи в молекуле хлора, и она распадается на два радикала: Сl2 + h 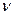
 2Cl•
2Cl•
На следующей стадии реакции радикал Cl• атакует молекулу метана, образуя НС1 и генерируя углеводородный радикал метил:
Н3С: Н + Cl •  НСl + CH3•
НСl + CH3•
Радикал метил атакует молекулу хлора с образованием молекулы хлористого метила и регенерацией радикала
CH3• + Cl: Cl  СН3Cl + Cl•
СН3Cl + Cl•
Хлористый метил
Затем процесс начинается снова. Точно таким же образом получаются и другие продукты процесса: CH2Cl2 - хлористый метилен, CHCl3 – хлороформ и CCl4 -четыреххлористый углерод.
Процессы такого типа называются радикально-цепными, поскольку в принципе один радикал хлора может вызвать (инициировать) хлорирование бесконечно большого числа молекул метана.
На практике течение цепных реакций ограничивается процессами обрыва цепи, при которых радикалы, реагируя один с другим, выбывают из процесса, например
2Cl•  Сl2; 2CH3•
Сl2; 2CH3•  CH3-CH3
CH3-CH3
2. Нитрование. Азотная кислота при обычной температуре почти не действует на предельные углеводороды; при нагревании же действует главным образом как окислитель. При нагревании (около1400С) и под давлением азотная кислота действует как нитрующий агент, т. е. один из атомов водорода предельного углеводорода замещается на остаток кислоты –NO2 (нитрогруппа):
RH + HO-NO2  R-NO2 + H2O
R-NO2 + H2O
Эта реакция тоже радикального типа и подчиняется тем же закономерностям, что и реакция галогенирования, т. е. легче всего замещается водород у третичного атома, затем у вторичного и труднее всего у первичного атома углерода.
3. Окисление. Окислители, даже такие, как хромовая смесь и марганцевокислый калий, при обычных температурах не действуют на предельные углеводороды.
При температуре выше 300оС предельные углеводороды воспламеняются и сгорают с образованием СО2 и Н2О:
С5Н12 + 8О2  5СО2 + 6Н2О
5СО2 + 6Н2О
При очень высоких температурах в промышленности реализован процесс взаимодействия метана с водой:
СН4 + Н2О  СО + 3Н2О
СО + 3Н2О
4. Сульфохлорирование. Эта реакция имеет большое значение в производстве моющих средств. Тяжелые фракции синтетических углеводородов С12–С18 в условиях ультрафиолетового облучения подвергаются совместному действию Cl2 и SO2. Образующиеся сульфонилхлориды при омылении щелочами дают соли сульфокислот:
а) Сl2  2Cl•;
2Cl•;
б) CH3(CH2)10CH3 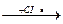 CH3(CH2)10CH2• + HCI
CH3(CH2)10CH2• + HCI
в)CH3(CH2)10CH2• 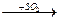 CH3(CH2)10CH2-SO2
CH3(CH2)10CH2-SO2 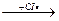
CH3(CH2)10CH2-SO2Сl 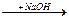 CH3(CH2)10CH2-SO3Na + HCI
CH3(CH2)10CH2-SO3Na + HCI
натриевая соль додекансульфо-кислоты (моющее средство)
Реакция сульфохлорирования, как и реакция радикального галогенирования, является цепной реакцией.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ






