а) Получение метана и его горение. В сухую пробирку 1, снабженную пробкой с газоотводной трубкой 2 (рис. 5), помещают смесь из обезвоженного уксуснокислого натрия и натронной извести (примерно 1:2) (высота слоя 6—10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки. Химизм процесса:
СНзСООNа + NaOH  CH4 + Na2CO3
CH4 + Na2CO3
 Поджигают выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем. Химизм процесса:
Поджигают выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем. Химизм процесса:
CH4 + 2O2  СО2 +2Н2О
СО2 +2Н2О
При нагревании натриевой соли уксусной кислоты с натронной известью происходит расщепление соли с образованием метана.
Нагревание натриевых солей карбоновых кислот с натронной известью является общим лабораторным способом получения предельных углеводородов.
б) Отношение метана к бромной воде и перманганату калия. В пробирку 2 помещают 5 капель раствора перманганата калия и в пробирку 3 -  5 капель бромной воды. Не прекращая нагревания смеси в пробирке 1, вводят поочередно конец газоотводной трубки в пробирки 2 и 3. Обесцвечивания растворов перманганата калия и бромной воды не происходит. В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жестких условиях, к реакциям присоединения алканы не способны.
5 капель бромной воды. Не прекращая нагревания смеси в пробирке 1, вводят поочередно конец газоотводной трубки в пробирки 2 и 3. Обесцвечивания растворов перманганата калия и бромной воды не происходит. В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жестких условиях, к реакциям присоединения алканы не способны.
Бромирование предельных углеводородов
(Опыт проводят в вытяжном шкафу!) В сухую пробирку помещают 4 капли смеси жидких алканов и добавляют 1—2 капли раствора брома. Содержимое пробирки перемешивают на холоду. Окраска брома при этом не исчезает. Нагревают содержимое пробирки до исчезновения окраски.
В отверстие пробирки вносят стеклянную палочку, смоченную раствором аммиака, — появляется белый дымок NH4Br. Пинцетом вносят в пробирку синюю лакмусовую бумагу, смоченную водой — лакмусовая бумага краснеет.
Химизм процесса:
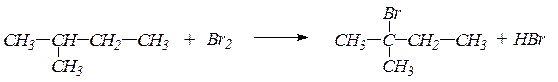
2-метилбутан 2-бром-2-метилбутан
Реакция бромирования жидких алканов сопровождается выделением бромистого водорода и проходит значительно медленнее, чем бромирование газообразных алканов.
Бромирование ускоряется добавлением катализаторов — железных опилок, амальгамированного алюминия, кристаллического йода. Легче всего галогенируются углеводороды с третичным атомом углерода в молекуле, труднее всего замещаются атомы водорода при первичном атоме углерода. Энергия связи водорода с третичным атомом углерода равна 90 ккал/моль, у вторичного — 94 ккал/моль, а у первичного 99 ккал/моль. Разница в скорости реакции галогенирования особенно сказывается при действии брома.






