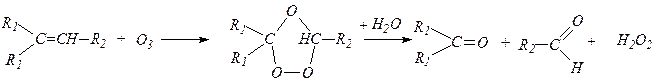В пробирку помещают 1 каплю исследуемого алкана (или смеси алканов), 1 каплю раствора углекислого натрия и 2—3 капли раствора марганцевокислого калия. Содержимое пробирки энергично взбалтывают; фиолетовая окраска водного слоя не изменяется, так как алканы в этих условиях не окисляются.
Действие концентрированной серной кислоты на предельные углеводороды
В пробирку помещают 2 капли жидкого алкана и 2 капли серной кислоты. Содержимое пробирки энергично перемешивают 1—2 мин, охлаждая пробирку проточной водой. В условиях опыта алканы с серной кислотой не реагируют.
При небольшом нагревании дымящая серная кислота образует с алканами, содержащими третичный углеродный атом, сульфокислоты. При высоких температурах серная кислота действует как окислитель.
Действие концентрированной азотной кислоты на предельные углеводороды
В пробирку помещают 2 капли исследуемого алкана и добавляют 2 капли азотной кислоты. Смесь встряхивают в течение 1—2 мин. Никакого изменения в пробирке не наблюдается.
Концентрированная азотная кислота на холоду не реагирует с алканами, при высокой температуре она действует как окислитель. Реакция нитрования алканов идет хорошо с разбавленной азотной кислотой при нагревании и повышенном давлении. Легче всего нитруются алканы, содержащие в молекуле третичный углеродный атом. Алканы легко нитруются в газовой фазе двуокисью азота или парами азотной кислоты при 250—500° С. Эта реакция идет по радикальному механизму.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему алканы называют также и парафинами?
2. Почему алканы характеризуются высокой стойкостью к окислителям?
3. Почему алканы не вступают в реакции присоединения?
4. Какая геометрическая конфигурация в молекулах алканов?
5. Какие связи имеются в молекулах алканов?
6. Из каких стадий состоит цепной процесс галогенирования алканов?
7. Что такое свободный радикал и почему они обладают повышенной реакционной способностью?
8. Почему при галогенировании алканов, в молекулах которых находятся более чем два атома углерода, образуется смесь галогеналканов?
9. Дайте определение радикально-цепному процессу.
10. Почему в реакции замещения атом водорода у третичного атома углерода замещается легче, чем у вторичного и хуже у первичного?
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема: АЛКЕНЫ
Цель работы: изучить методы получения и химические свойства алкенов.
Оборудование и реактивы: этиловый спирт, 96%-ный; серная кислота (d = 1,84 г/см3); этилен; бромная вода, насыщенный раствор; марганцевокислый калий, 0,1 н. раствор; жидкие алкены (керосин); раствор брома в органическом растворителе; аммиак, 25%-ный раствор; лакмусовая бумага синяя; углекислый натрий, 1 н. раствор; азотная кислота (d = 1,4 г/см3). песок, газоотводная трубка; стеклянная палочка.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Методы получения
1. При действии спиртовых растворов едких щелочей на галогенпроизводные отщепляется галогенводород и образуется двойная связь:
СН3-СН2-CH2Br 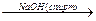 СН3-СН2=CH2 + NaBr + H2O
СН3-СН2=CH2 + NaBr + H2O
Если в 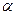 -положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).
-положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).
|
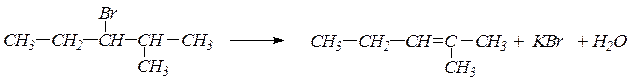
2. Действием на спирты водоотнимающих средств:
а) при пропускании спиртов над окисью алюминия при 300—400о С
 СН3-CH-СН2-СН3
СН3-CH-СН2-СН3 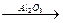 СН3-CH=СH-СН3 + H2O
СН3-CH=СH-СН3 + H2O 
ОН
б) при действии на спирты серной кислоты в мягких условиях (реакция идет через промежуточное образование эфиров серной кислоты):
СН3-CH-СН3 + H2SO4 
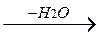 СН3-CH-СН3
СН3-CH-СН3 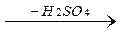 СН3-CH=СН2
СН3-CH=СН2
│ │ 
ОН OSO3H
3. При действии Zn или Мg на дигалогенпроизводные с двумя атомами галогена у соседних атомов углерода:
СН3-CH-СН2Cl 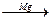 СН3-CH=СН2
СН3-CH=СН2
│
 Сl
Сl
4. Гидрированием ацетиленовых углеводородов над катализаторами:
СН3-С 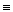 CH
CH 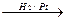 СН3-СН=CH2
СН3-СН=CH2
5. Алкены в виде сложных смесей получаютсяпри крекинге нефти
С10Н22 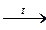 C5H10 + C5H12
C5H10 + C5H12
Химические свойства
Наличие в молекулах алкенов двойной связи, состоящей из 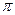 - и
- и 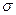 - связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как
- связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как 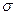 -связь прочнее чем
-связь прочнее чем 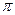 связь.
связь.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
1. Присоединение водорода. Присоединение водорода к алкенам приводит к образованию предельных углеводородов:
СН3-СН=CH2 + Н2 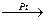 СН3-СН2-CH3
СН3-СН2-CH3
2. Присоединение галогенов. Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т. е. содержащих атомы галогена у соседних атомов углерода.
На первой стадии этой реакции происходит взаимодействие между 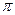 -электронами двойной связи и электрофильной частицей галогена с образованием так называемого
-электронами двойной связи и электрофильной частицей галогена с образованием так называемого 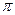 -комплекса I, который через стадию образования карбкатиона II распадается на продукт реакции III.
-комплекса I, который через стадию образования карбкатиона II распадается на продукт реакции III.
[R-CH=CH-R --- Cl 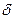 +- Cl
+- Cl 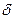 -]
-]  [R-CHCl-CH-R]•Cl-]
[R-CHCl-CH-R]•Cl-]  R-CHCl-CHCl-R
R-CHCl-CHCl-R
I II III
3. Присоединение галогенводородов. Галогенводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
R-CH=CR2 + HBr  R-CH2-CR2Br
R-CH2-CR2Br
Эта реакция, как и присоединение брома к этилену, идет после образования 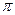 -комплекса через стадию образования соответствующего карбкатиона.
-комплекса через стадию образования соответствующего карбкатиона.
[R-CH=CR2 --- Н 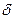 +- Cl
+- Cl 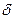 -]
-]  [R-CH2-CR2]+•Cl-
[R-CH2-CR2]+•Cl- 
 R-CH2-CR2Cl
R-CH2-CR2Cl
В присутствии перекисей бромистый водород присоединяется не по правилу Марковникова (эффект Хараша).
В присутствии перекисей реакция идет не по механизму электрофильного присоединения, как выше, а по радикальному механизму (Xapaш). Первой стадией является атака перекисного радикала на молекулу HBr:
RCOO• + HBr  RCOOH + Br•
RCOOH + Br•
Возникший радикал брома может присоединяться к алкену с образованием новых радикалов I и II, в связи с чем, реакция должна протекать по двум направлениям:
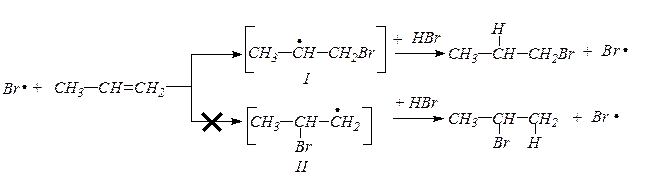
Но направление процесса определяется устойчивостью промежуточных образований-радикалов I и II. Не спаренный электрон более стабилен у вторичного углерода (индукционный эффект), поэтому реакция протекает через промежуточный радикал I.
4. Присоединение воды и серной кислоты. В присутствии кислот вода присоединяется по двойной связи в соответствии с правилом Марковникова:
R-CH=CН2 + H2О 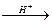 R-CH-CН3
R-CH-CН3
│
ОН
Так же идет и реакция с серной кислотой:
R-CH=CН2 + H2SО4  R-CH-CН3
R-CH-CН3
│ 

OSО3H
5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
3R-CH=CH-R + 2KMnO4 + 4H2O  3R-CH – CH–R+ 2KOH + 2MnO2
3R-CH – CH–R+ 2KOH + 2MnO2
│ │ 
 OH OH
OH OH
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С связи с образованием кислот или кетонов:
(СН3)2С=СН-СН3 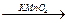 (СН3)2С=O + СН3COOH
(СН3)2С=O + СН3COOH
6. Действие озона на алкены. Действие озона на алкены приводит к образованию кристаллических сильно взрывчатых озонидов, которые при гидролизе образуют альдегиды или кетоны: