Химической реакции.
Существую два теоретических подхода к трактовке элементарного акта химической реакции.
Теория активных соударений (ТАС)
В теории активных соударений используются основные положения молекулярно-кинетической теории. Для того, чтобы произошло химическое взаимодействие, молекулы реагирующих веществ должны столкнуться. Число столкновений молекул в идеальном газе, представляющем собой смесь реагирующих газообразных веществ очень велико и поэтому все газообразные реакции должны протекать практически мгновенно, что не соответствует экспериментальным данным. Следовательно, не каждое столкновение молекул приводит к реакции, а только эффективное. По Аррениусу, в реакцию вступает только активные молекулы.
Заслугой ТАСС является установление того факта, что активные молекулы, вступающие в реакцию, по своему строению и свойству ничем не отличаются от обычных молекул, но они имеют некоторый избыток энергии по сравнению со среднем уровнем. Эта избыточная энергия есть энергия активации, являющаяся характерной величиной для каждой конкретной реакции.
Рассмотрим распределение молекул идеального газа по кинетической энергии Екин согласно статистическому закону Максвелла-Гольцмана, при двух различных температурах. Если Еа – характерный порог энергии для данной реакции, а N – общее число молекул, то доли молекул NЕ→∞ / N с кинетической энергией превышающей энергию активации (Екин ≥ Еа) численно равны заштрихованной площади. (рис. 2.5)
С помощью закона Гольцмана можно определить количество активных столкновений Zакт, т.е. таких, в которых энергия превышает энергию активации:
Zакт = Z * 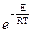 (2.29)
(2.29)
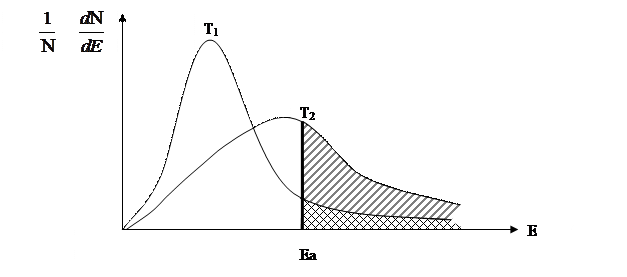
Рис. 2.5 Распределение молекул идеального газа по кинетической энергии согласно статистическому закону Максвелла-Гольцмана при двух значениях температуры.(Т2 >Т1)
Если рассматривать бимолекулярную реакцию типа 2А → Р, где в результате каждого активного столкновения расходуется две молекулы, количество прореагировавших молекул в единице объема в единицу времени, т.е. скорость реакции – В будет равна удвоенному количеству активных столкновений:
V = 2Zакт
Подставим сюда Zакт: V = 2Z * 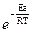
Для данной реакции согласно закона действующих масс V = К * С2, но так как К – скорость реакции при концентрации равной 1, выражение для константы можно записать
К = V/С2 = 2Z/С2 * 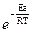
Если полученное выражение сравнить с уравнением Аррениуса: К = К0 * 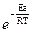 , то можно установить физический смысл предъэкспоненциального множителя К0, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема в единицу времени.
, то можно установить физический смысл предъэкспоненциального множителя К0, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема в единицу времени.
В случае единичной концентрации, С = 1, величина К0 отличается от Z для рассматриваемой реакции лишь коэффициентом 2.
Можно показать, что для реакции типа А + В → P этот коэффициент равен 1. по этой причине уравнение Аррениуса пишут в виде:
К = Z * 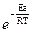 (2.30)
(2.30)
Где под Z понимают просто количество столкновений в единицу времени в единице объема. Хорошо совпадение при использовании ТАСС отличалось для газовой реакции разложения йодистого водорода. Однако при взаимодействии более сложных газовых молекул и для реакции в растворах часто наблюдается расхождение расчетных значений скоростей реакций с данными опыта. Такие отклонения можно объяснить предположив, что реагируют лишь определенным образом ориентированные при столкновении активные молекулы. Поэтому из общего количества эффективных столкновений рассчитанных по теории, следует считать действительно эффективными лишь некоторую часть. По этому, выражение для константы скорости записывают следующим образом:
К = р * Z * 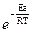 (2.31)
(2.31)
Где р, так называемый стерический фактор, или фактор вероятности. Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходимо определенная ориентация реагирующих молекул. Из термодинамических соображений следует, что стерический фактор должен быть связан с изменением энтропии в ходе реакции.






