Перейдем от состояния вещества к процессам от абсолютных значений энтропий к их изменениям, обусловленным химическим взаимодействием. Зная значения стандартных энтропий можно рассчитать изменение энтропии при протекании химической реакции:
∆rS0298 = Σ vi S0298 i (продуктов реакции) - Σ vj S0298 j (исходных веществ),
Так, для реакции v 1 А1 + v 2 А2 = v 3 А3 + v 4 А4;
∆rS0298 = [ v 3S0298(А3) + v 4 S0298(А4) ] - [ v 1S0298(А1) + v 2S0298(А2) ]
Например, для процесса протекающего при стандартных условиях
Н2(г) + ½ О2(г) = Н2О(ж); ∆rS0298
∆rS0298 = S0298 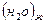 - (S0298
- (S0298  + ½ S0298
+ ½ S0298  ) = 69,95 – 130,52 – ½ 205,04 = - 163,14 Дж/моль*К
) = 69,95 – 130,52 – ½ 205,04 = - 163,14 Дж/моль*К
Стандартная энтропия любого вещества является положительной величиной (S0298 >0), изменения энтропии в процессах (∆rS) могут быть положительными, отрицательными или равными нулю.
Температурная зависимость стандартной энтропии реакции.
Стандартная энтропия реакции при Т ≠ 298 К вычисляется с учетом теплоемкостей исходных веществ и продуктов реакции.
∆rS0(т) = ∆rS0298 +  dT (1.55)
dT (1.55)
Если считать, что теплоемкость не является функцией температуры ∆Ср(Т) ≠ f(T), но после интегрирования получим:
∆rS0(т) = ∆rS0298 + ∆Ср * ln  (1.56)
(1.56)
При температурной зависимости теплоемкости, которая выражается степенным рядом:
∆Ср0 = ∆а + ∆в * Т
формула (1.55) принимает вид:
∆rS0(т) = ∆rS0298 +  dT = ∆rS0298 + ∆а * ln
dT = ∆rS0298 + ∆а * ln  + ∆в (Т - 298) (1.57)
+ ∆в (Т - 298) (1.57)
Изменение энергии Гиббса
Изменение энергии Гиббса - критерий направленности самопроизвольного процесса в закрытой системе. Реальные процессы происходят, как правило, в закрытых системах в изобарно-изотермических (р,Т = const) условиях, это наиболее типичный режим для самых различных процессов. Из уравнения (1.50) при р = const и Т = const находим
δА' ≤ - d (U + pv - TS) р,Т (1.58)
введем обозначение
δА' ≤ - d (Н - TS) (1.59)
G = H – TS (1.60)
Функция G является функцией состояния системы и называется энергией Гиббса или изобарно-изотермическим потенциалом. Энергия Гиббса при р,Т = const является экстенсивным свойством системы ее абсолютные значения не поддаются вычислению.
Для обратимого процесса
δА' = dА' max = - (dG) р,Т (1.61)
А' max = - (G2 – G1) = - (ΔG) р,Т (1.62)
Отсюда для обратимого (квазистатического) процесса при рассматриваемых условиях максимальная (полезная) работа (А' max) приобретает свойства функции состояния и равна убыли энергии Гиббса.
Уравнение (1.60) можно переписать в виде Н = G + T * S, где энергия Гиббса характеризует ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермический процесс. В этом состоит физический смысл величины G. Величина Т * S характеризует связанную энергию, т.е. ту часть полной энергии системы, которая рассматривается в окружающей среде в виде теплоты. Для установления критерия направленности самопроизвольного процесса в закрытой системе продифференцируем уравнение (1.60).
dG = dU + pdv + vdP – TdS – SdT (1.63)
Согласно выражению (1.52), ТdS ≥ dU + рdV
dU ≤ ТdS – рdV (1.64)
Подставим в уравнение (1.63) вместо dU большую либо равную ей величину ТdS – рdV получим следующие неравенство:
dG ≤ - S * dТ + Vdр (1.65)
Для изобарно-изотермического процесса (р,Т = const, dp = dT = 0) выражение (1.65) примет вид (dG)р,Т ≤ 0, или для конечных изменений энергии Гиббса
(ΔG)р,Т ≤ 0 G → Gmin (1.66)
Следовательно, в закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях:
1. если ΔG = 0 (G → Gmin, энергия Гиббса достигла минимального значения), то система находится в состоянии термодинамического равновесия;
2. если ΔG < 0 (G → Gmin, энергия Гиббса убывает), то процесс в данном направлении термодинамически возможен;
3. если ΔG > 0, процесс в данном направлении термодинамически невозможен.
Применяя выражение (1.65) к обратимому равновесному процессу, получим
dG = – SdT + VdP (1.67)
из условия (1.67) вытекает
 (1.68)
(1.68)
 (1.69)
(1.69)
Из соотношений (1.68) следует, что объем системы, служит мерой возрастания энергии Гиббса при увеличении давления при постоянной температуре, а энтропия – мерой убыли энергии Гиббса с возрастанием температуры при постоянном объеме. Такие функции состояния, частные производные которых по соответствующим отработанным параметрам состояния в явной форме выражают другие параметры, называются характеристическими. Подставляя (1.69) в (1.60), получим
G = H + T  , или для процесса (в том числе и для химической реакции) изменение энергии Гиббса при переходе системы из состояния 1 в состояние 2
, или для процесса (в том числе и для химической реакции) изменение энергии Гиббса при переходе системы из состояния 1 в состояние 2
∆rG0(т) = ∆rН0(т) + Т 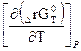 , (1.70)
, (1.70)
Где 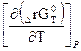 = – ∆rS0(т)
= – ∆rS0(т)
Выражение (1.70) называется уравнением Гиббса-Гельмгольца, оно связывает изменение энергии Гиббса химической реакции с ее тепловым эффектом и температурой. Иначе его можно записать в виде
∆rG0т = ∆rН0т - Т∆rS0т (1.71)
Анализ уравнения (1.71) показывает, что знак и величина ∆rG0т зависят от двух факторов: энтальпийного - ∆rН0т и энтропийного Т∆rS0т . Соотношение этих факторов определяет термодинамическую возможность самопроизвольного протекания реакции в закрытой системе при р,Т = const.
С одной стороны, в ходе химической реакции система стремиться перейти к минимальному уровню энтальпии, выделив часть ее в форме теплоты (∆rН0т < 0), с другой стороны, система стремиться занять наиболее вероятное состояние, характеризующееся максимумом беспорядка, т.е. максимумом энтропии (∆rS0т > 0).
Если процесс протекает так, что ∆rН0т = 0, то рост энтропии становится единственной движущей силой. И, наоборот, при условии ∆rS0т = 0, движущей силой процесса является убыль энтропии.
Компенсация энтропийного и энтальпийного факторов соответствует установлению равновесия в системе.
∆rН0т = Т ∆rS0т (1.72)
Изменение энергии Гиббса химической реакции при стандартных термодинамических условиях (р = 101,3 кПа, Т = 298 К) можно вычислить по уравнению ∆rG0298 = ∆rН0298 - ∆rS0298 * 298;
Возможен и другой путь расчета ∆rG0298 - по стандартным энергиям Гиббса образования исходных веществ и продуктов реакции ∆fG0298;
∆rG0298 =  (1.73)
(1.73)
Стандартной энергией Гиббса образования вещества ∆fG0298 называется изменение энергии Гиббса в реакции образования одного моля данного соединения из простых веществ, находящихся в термодинамически устойчивых модификациях, проведенной в стандартных термодинамических условиях.
Если в таблице нет значения ∆fG0298 для какого-либо сложного вещества, его можно вычислить по уравнению
∆fG0298 = ∆fН0298 – 298 ∆fS0298; (1.74)
где ∆fН0298 и ∆fS0298 – стандартные изменения энтальпии и энтропии соответственно в реакции образования одного моля этого соединения из простых веществ, находящихся в термодинамически устойчивых состояниях, проведенной в стандартных термодинамических условиях.






