химической реакции - ∆rG0т
Стандартную энергию Гиббса реакции ∆rG0т при Т ≠ 298 К можно рассчитать по уравнению. (1.71) При практических расчетах ∆rG0т применяют следующие степени приближения:
1. Стандартный тепловой эффект (стандартную энтальпию) и стандартную энтропию реакции считают не зависящими от температуры, при этом уравнении (1.71) принимает вид:
∆rG0т = ∆fН0298 – Т ∆fS0298 (1.75)
2. В уравнении (1.71) подставляются зависимые от температуры значения теплового эффекта и энтальпийного эффекта рассчитанные при условии ∆Ср0 = const.
3. Используется уравнение
∆rG0т = ∆rН0298 – ∆rS0298 * Т + ∆Ср(Т - 298) - Т∆Ср ln T/298 (1.76)
Направление процессов в открытых многокомпонентных системах.
Химический потенциал.
Рассматривавшиеся до сих пор термодинамические соотношения не учитывали возможных изменений числа молей за счет химических реакций или перехода вещества из одной фазы в другую. Другими словами, мы рассматривали закрытые системы, которые не обмениваются веществом с окружающей средой, хотя могут обмениваться с ней теплотой и работой. Открытая система допускает обмен веществом с окружающей средой. Поэтому, рассматриваемый нами изобарно-изотермический потенциал является функцией не только ранее указанных переменных, но и состава системы, G = f (T, р, v 1 ,v 2 ,v 3..) и поэтому общее изменение энергии Гиббса будет завесить не только от изменения давления, температуры, но и от количества введенного в систему или выведенного из нее. Обозначим индексом v jусловие постоянства v 1 ,v 2 ,v 3т.е. чисел молей всех веществ кроме вещества i, и индексом N состав. (т.е. число молей всех веществ).
Дифференцирование по всем переменным дает:
dG = 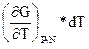 +
+  +
+ 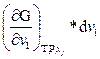 +
+ 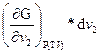 + … =
+ … =
= 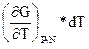 +
+  +
+ 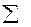
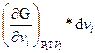 (1.77)
(1.77)
После подстановки в уравнение (1.77) значений производных 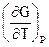 = - S и
= - S и 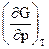 = V получим
= V получим
dG ≤ - SdT + VdP + 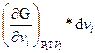 (1.78)
(1.78)
Величина 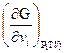 получила название химического потенциала μi вещества i
получила название химического потенциала μi вещества i
μi = 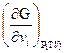 (1.79)
(1.79)
Химический потенциал, это термодинамическая функция, характеризующая состояние какого-нибудь компонента i в фазе данного состава при определенных внешних условиях. На основании формулы (1.79) он равен приращению изобарно-изотермического потенциала это фазы при ведении в нее дополнительного количества компонента i при постоянных температуре и давлении и постоянных количествах каждого из остальных компонентов содержащихся в данной фазе.
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации каждого из других компонентов в данной фазе. Только в простейшем случае – смеси идеальных газов - μi зависит лишь от концентрации рассматриваемого компонента i (и от температуры). В этом случае химический потенциал определяется простым соотношением
μi = μi0 + RT lnpi (1.80)
где pi - парциальное давление компонента i в смеси
μi0 – значение μi при pi = 1
Химический потенциал играет большую роль при рассмотрении как гетерогенных, так и гомогенных процессов и равновесий. В гетерогенных системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу для которой он меньше. Такой переход сопровождается уменьшением химического потенциала в первой фазе и увеличением во второй. В результате этого разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и при достижении равновесия химический потенциал компонента станет одинаковым в обеих фазах.
Для того чтобы показать, что химический потенциал может быть критерием направления процесса и равновесия, обратимся к уравнению (1.78). Если принять р,Т = const, т.е. dр = 0 и dТ = 0,то уравнение принимает вид:
dG ≤ 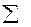
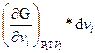 =
= 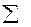 μi
μi  (1.81)
(1.81)
Для закрытой системы условием равновесия служит dG = 0 и dG < 0 при протекании самопроизвольного процесса. Эти условия сохраняют силу и для открытой системы:
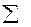 μi
μi  ≤ 0 (1.82)
≤ 0 (1.82)
Таким образом, при постоянных температуре давлении для слабого гомогенного и гетерогенного термодинамического процесса - общим условием возможности самопроизвольного течения процесса в прямом направлении служит неравенство
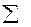 (μi
(μi  ) < 0
) < 0
Это неравенство показывает, что алгебраическая сумма произведений химических потенциалов (μi ) компонентов на изменение числа молей их ( ) в ходе процесса меньше нуля. По мере течения процесса она приближается к нулю и условием равновесия служит равенство
) в ходе процесса меньше нуля. По мере течения процесса она приближается к нулю и условием равновесия служит равенство
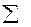 (μi
(μi  ) = 0
) = 0
В химической термодинамике потенциал обычно относится к одному молю компонента. При этом измеряется в единицах энергии на моль.






