Ќеобратимые и обратимые химические реакции.
огда при химическом взаимодействии хот€ бы одной из исходных веществ расходуетс€ полностью реакцию можно считать протекающей до конца, такую реакцию называют необратимой.
Ќапример, Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O.
ѕри достаточном количестве азотной кислоты реакци€ закончитс€ тогда, когда весь Zn расходуетс€. » если попытатьс€ привести эту реакцию в обратном направлении Ц пропустить диоксид азота через раствор нитрата Zn то, металлического Zn и азотной кислоты не получитс€ Ц данна€ реакци€ не может протекать в обратном направлении.
ƒругим примером необратимой реакции может быть разложение бертолетовой соли:
KClO3 → KCl + 1,5O2
необратимым прин€то относить взаимодействие между веществами, в результате которых образуютс€ осадки, газы или мало диссоциированные соединени€.
BaCl2 + Na2SO4 = BaSO4↓+2NaCl
NaCO3 + 2HCl = 2NaCl + CO2↑+ H2O
ќднако кажда€ из приведенных реакций лишь практически необратима.
¬ химии растворов электролитов рассматриваетс€ возможность процессов.
BaSO4 → Ba2+ + S 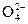
CO2 + H2O → 2H + C 
H2O → H+ + OH-
ќбратимых выделению осадков, газа, образованию мало диссоциированрого соединени€. ак показывает опыт, большинство химических реакций протекают одновременно в сторону образовани€ продуктов реакции (вправо, пр€ма€ реакци€), так и в сторону превращени€ последних в исходные вещества (влево, обратна€ реакци€). “акие реакции называютс€ химически обратимыми.
»з основного постулата химической кинетики следует, что скорости реакций в любой момент времени, кроме τ = τравн, имеют конечную величину. ѕоэтому с точки зрени€ термодинамики все они необратимы. —корость обратимой реакции равна разности между скорост€ми пр€мой и обратной реакции в данный момент времени. ≈сли рассмотреть общий случай реакции вида ај + в¬  mM + nN, то скорость пр€мой реакции определ€етс€ уравнением
mM + nN, то скорость пр€мой реакции определ€етс€ уравнением
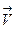 = -
= -  = 1 *
= 1 *  (а)
(а)
ј скорость обратной реакции
 =
=  = 2 *
= 2 *  (в)
(в)
√де 1 Ц константа скорости пр€мой реакции - 
а Ц константа скорости обратной реакции 
 ≈сли в начальном состо€нии системы в ней содержались только вещества ј и ¬, то скорость пр€мой реакции уменьшаетс€ по мере течени€ ее в соответствии с уменьшением их концентраций. «ависимость этой скорости от времени можно представить кривой I на рисунке (2.3);
≈сли в начальном состо€нии системы в ней содержались только вещества ј и ¬, то скорость пр€мой реакции уменьшаетс€ по мере течени€ ее в соответствии с уменьшением их концентраций. «ависимость этой скорости от времени можно представить кривой I на рисунке (2.3);
≈сли бы не было обратной реакции, эта крива€ достигла бы оси абсцисс при израсходовании одного из исходных веществ. рива€ II, относ€ща€с€ к скорости обратной реакции, начинаетс€ в начале координат (так как по условию в начальный момент C'A = C'¬ = 0) и повышаетс€ по мере течени€ пр€мой реакции и вызываемого его увеличени€ этих концентраций.
ќбща€ скорость реакции в любой данный момент равна разности скоростей пр€мой и обратной реакции
V = -  =
=  *
*  -
- 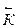
 (2.25)
(2.25)
ќчевидно, что при дальнейшем течении реакции указанные две кривые Ц скоростей пр€мой и обратной реакции Ц должны где-то пересечьс€, т.е. должно быть достигнуто такое состо€ние, при котором скорости 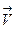 пр€мой и
пр€мой и  обратной реакции станут равными между собой. огда обе скорости сравн€ютс€, наступит состо€ние химического равновеси€ Ц концентрации реагирующих веществ станов€тс€ вполне определенными и посто€нными во времени (при условии, что давление и температура не мен€ютс€).
обратной реакции станут равными между собой. огда обе скорости сравн€ютс€, наступит состо€ние химического равновеси€ Ц концентрации реагирующих веществ станов€тс€ вполне определенными и посто€нными во времени (при условии, что давление и температура не мен€ютс€).
|
|
|
“аким образом, кинетическим условием химического равновеси€ €вл€етс€ равенство скоростей 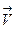 =
=  , а концентрации веществ в равновесной системе называютс€ равновесными (
, а концентрации веществ в равновесной системе называютс€ равновесными ( ).
).
≈сли скорости равны между собой, следовательно должны быть равны и правые части уравнений (а) и (в).
1 *  = 2 *
= 2 * 
ќткуда

ѕрава€ часть равенства представл€ет собой константу равновеси€ ( с) данной реакции
с =  (2.26)
(2.26)
—ледовательно,
с =  =
=  (2.27)
(2.27)
¬еличина, равна€ отношению произведени€ равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степен€х их стехиометрических коэффициентов, называетс€ константой химического равновеси€.
онцентрации газообразных веществ в выражении (2.27) могут быть заменены равновесными парциальными давлени€ми этих веществ.
р =  =
=  (2.28)
(2.28)
(ѕарциальное давление Ц давление компонента газовой смеси, которое он имел бы при представлении ему объема занимаемого всей смесью газов).
≈сли обратима€ реакци€ протекает в гетерогенной системе, в которой нар€ду с газообразными реагентами участвуют твердые и жидкие вещества (не образующие друг с другом растворов), то при данной температуре парциальные давлени€ реагентов, наход€щиес€ в конденсированном состо€нии, посто€нны и не завис€т от количества реагентов (как и давление посто€нного пара какого-либо чистого индивидуального вещества, например воды при данной температуре).
ѕоэтому эти парциальные давлени€, независимо от того, малы они или существенны, известны или неизвестны, можно включить в константу равновеси€. —ледовательно, в подобных случа€х в выражении (2.28) следует ввести толь равновесные парциальные давлени€ газообразных веществ.
“ак дл€ реакции, FeO(k) + CO(г)  Fe(k) + CO2(г)
Fe(k) + CO2(г)
р = 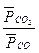
ѕолученные уравнени€ (2.27) и (2.28) справедливы только дл€ элементарных реакций. ¬ общем случае дл€ сложных превращений, дл€ получени€ зависимости между величинами с, р,  нужны знани€ о механизме процессов.
нужны знани€ о механизме процессов.
 »так, равенство скоростей (
»так, равенство скоростей (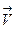 =
=  ) €вл€етс€ кинетическим условием химического равновеси€, но при этом надо помнить, что люба€ реакци€ при посто€нных температуре и давлении протекает самопроизвольно в направлении убыли энергии √иббса. ѕределом этой убыли €вл€етс€ минимальное значение энергии √иббса. Ќа рисунке 2.4 представлено изменение энергии √иббса дл€ обратимой реакции (ј
) €вл€етс€ кинетическим условием химического равновеси€, но при этом надо помнить, что люба€ реакци€ при посто€нных температуре и давлении протекает самопроизвольно в направлении убыли энергии √иббса. ѕределом этой убыли €вл€етс€ минимальное значение энергии √иббса. Ќа рисунке 2.4 представлено изменение энергии √иббса дл€ обратимой реакции (ј  ¬) осуществл€емой в закрытой системе в изобарно-изотермических услови€х. (–,“ = const), в зависимости от состава реакционной смеси.
¬) осуществл€емой в закрытой системе в изобарно-изотермических услови€х. (–,“ = const), в зависимости от состава реакционной смеси.
–ис. 2.4 »зменение энергии √иббса дл€ обратимой реакции (ј  ¬) в зависимости от состава смеси.
¬) в зависимости от состава смеси.
“очке ј соответствует состав 100 % вещества ј, а точке ¬ Ц 100 % вещества ¬. ѕроцесс ј → ¬ идет самопроизвольно до тех пор, пока величина энергии √иббса системы уменьшаетс€ от GA до Gmin , и процесс ¬ → ј идет самопроизвольно до тех пор пока G¬ уменьшитс€ до Gmin.
“очка — на оси абсцисс отвечающа€ минимальному значению энергии √иббса (Gmin) определ€ет равновесный состав смеси при заданных услови€х (–,“). —осто€ние равновеси€ характеризуетс€ равенством ∆Gр,т = 0
|
|
|






