Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций (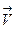 =
=  ) и минимальному значению энергии Гиббса (∆Gр,т = 0), является наиболее устойчивым состоянием системы при заданных условиях и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось.
) и минимальному значению энергии Гиббса (∆Gр,т = 0), является наиболее устойчивым состоянием системы при заданных условиях и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось.
При изменении условий равновесие нарушается и смещается в сторону прямой или обратной реакции. Смещение равновесия связано с тем, что внешнее воздействие в разной степени изменяет скорость двух взаимно противоположных процессов. Через некоторое время система вновь становится равновесной, т.е. она переходит из одного равновесного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
Направление смещения равновесия в общем случае определяется принципом Ле Шателье: если на систему, находящуюся в состоянии устойчивого равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону процесса, ослабляющего эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, концентрации (давления) одного из реагентов.
Температура – тот параметр, от которого зависит величина константы равновесия химической реакции. Вопрос смещения равновесия при изменении температуры в зависимости от условий использования реакции решается путем использования уравнения изобары (1.90) -  =
= 
1. Для изотермического процесса ∆rН0(т) < 0, в правой части выражения (1.90) R > 0, T > 0, следовательно первая производная логарифма константы равновесия по температуре отрицательна  < 0, т.е. ln Kp (и сама константа Кр) являются убывающими функциями температуры. При увеличении температуры константа химического равновесия (Кр) уменьшается и что согласно закону действующих масс (2.27), (2.28)соответствует смещению химического равновесия в сторону обратной (эндотермической) реакции. Именно в этом проявляется противодействие системы оказанному воздействию.
< 0, т.е. ln Kp (и сама константа Кр) являются убывающими функциями температуры. При увеличении температуры константа химического равновесия (Кр) уменьшается и что согласно закону действующих масс (2.27), (2.28)соответствует смещению химического равновесия в сторону обратной (эндотермической) реакции. Именно в этом проявляется противодействие системы оказанному воздействию.
2. Для эндотермического процесса ∆rН0(т) > 0 производная логарифма константы равновесия по температуре положительна ( > 0), тема образом ln Kp и Кр являются возрастающими функциями температуры, т.е. в соответствии с законом действующих масс при увеличении температуры равновесие смещается в сторону прямой (эндотермической реакции). Однако надо помнить, что скорость как изотермического так и эндотермического процессов при повышении температуры возрастает, а при понижении понижается, но изменение скоростей
> 0), тема образом ln Kp и Кр являются возрастающими функциями температуры, т.е. в соответствии с законом действующих масс при увеличении температуры равновесие смещается в сторону прямой (эндотермической реакции). Однако надо помнить, что скорость как изотермического так и эндотермического процессов при повышении температуры возрастает, а при понижении понижается, но изменение скоростей 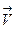 и
и  при изменении температуры неодинаково, поэтому, варьируя температуру, можно смещать равновесия в заданном направлении. Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом из системы.
при изменении температуры неодинаково, поэтому, варьируя температуру, можно смещать равновесия в заданном направлении. Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом из системы.
По принципу Ле Шателье при изменении концентрации одного из участников реакции равновесие смещается в сторону компенсирующую изменение, т.е. при увеличении концентрации одного из исходных веществ – в правую сторону, а при увеличении концентрации одно из продуктов реакции – в левую. Если в обратимой реакции участвуют газообразные вещества, то при изменении давления, одинаково и одновременно изменяются все их концентрации. Изменяются и скорости процессов, а следовательно, может произойти и смещение химического равновесия. Так, например, при увеличении давления (по сравнению с равновесным) на систему СаСО3(К)  СО(к) + СО2(г) возрастает скорость обратной реакции
СО(к) + СО2(г) возрастает скорость обратной реакции  =
=  что приведет к смещению равновесия в левую сторону. При понижении давления на туже систему скорость обратной реакции уменьшается, и равновесие смещается в правую сторону. При увеличении давления на систему 2HCl
что приведет к смещению равновесия в левую сторону. При понижении давления на туже систему скорость обратной реакции уменьшается, и равновесие смещается в правую сторону. При увеличении давления на систему 2HCl  H2+Cl2, находящуюся в состоянии равновесия, смещение равновесия не произойдет, т.к. обе скорости
H2+Cl2, находящуюся в состоянии равновесия, смещение равновесия не произойдет, т.к. обе скорости 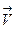 и
и  возрастут одинаково.
возрастут одинаково.
Для системы 4HCl + О2  2Cl2 + 2Н2О(г) увеличение давления приведет к увеличению скорости прямой реакции и смещению равновесия вправо.
2Cl2 + 2Н2О(г) увеличение давления приведет к увеличению скорости прямой реакции и смещению равновесия вправо.
И так, в соответствии с принципом Ле Шателье при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газовой смеси и соответственно в сторону уменьшения давления в системе.
И наоборот, при внешнем воздействии, вызывающем понижение давления, равновесие смещается в сторону образования большего количества молей газообразных веществ, что вызовет увеличение давления в системе и будет противодействовать произведенному воздействию.
Принцип Ле Шателье имеет большое практическое значение. На его основе можно подобрать такие условия осуществления химического взаимодействия, которые обеспечат максимальный выход продуктов реакции.






