2. по виду кинетического уравнения для скорости реакции – по порядку реакции; эта классификация не делает различия, между простыми и сложными, то есть многостадийными реакциями. Различают: порядок реакции по данному веществу (частный порядок) и общий или полный кинетический порядок реакции.
Порядком реакции по данному веществу называют показатель степени при концентрации вещества, входящего в кинетическое уравнение. Так, если кинетическое уравнение имеет вид: V = К *  , то показатель степени (q) определяет частный порядок по веществу А, а сумма чисел q + p + k соответствует общему (иногда говорят полному) кинетическому порядку реакции. Следует подчеркнуть, что величины q, p, k определяются только экспериментальным путем, и для большинства реакции реакций порядки реакций по вещества не равнозначны стехиометрическим коэффициентам.
, то показатель степени (q) определяет частный порядок по веществу А, а сумма чисел q + p + k соответствует общему (иногда говорят полному) кинетическому порядку реакции. Следует подчеркнуть, что величины q, p, k определяются только экспериментальным путем, и для большинства реакции реакций порядки реакций по вещества не равнозначны стехиометрическим коэффициентам.
Порядок реакции – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым. Как уже было указано, порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для реакций формально похожих.
Например, скорость реакции Н2 + I2 = 2НI, согласно опытным данным может быть записана следующим образом:
V = К *  *
* 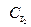 , где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен двум.
, где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен двум.
Для, казалось бы, аналогичной реакции Н2 + Br2 = 2НBr опытным путем найдено, что V = 
Сложность написанного уравнения и порядок дробный и даже кажущийся отрицательный по отдельным веществам отражают многоступенчатый механизм течения рассматриваемой реакции. Она может быть представлена рядом элементарных активов.
Br2 = 2Br
Br + Н2 = НBr + Н
Н + Br2 = НBr + Br
Н + НBr = Н2 + Br
Br + Br = Br2
Каждая из этих стадий может быть описана простым уравнением, а суммарный итог, как уже видели описывается сложным уравнением.
Нулевой порядок реакции указывает на 6независимость в данном случае скорости реакции от концентрации реагирующих веществ. Иногда при большом избытке одного из реагирующих веществ по сравнению с другим, его концентрация остается практически постоянной. Тогда общий порядок называется псевдопорядком.
Итак, порядок реакции в значительной степени зависит от механизма процесса. Поэтому факторы, влияющие на механизм процесса (температура, катализатор, концентрация вещества) могут влиять на величину порядка реакции.
Следует еще раз подчеркнуть, что молекулярность и порядок реакции понятия разные. Численные их значения могут совпадать лишь в элементарном акте химического превращения.






