Химическая термодинамика указывает на принципиальную возможность протекания конкретной реакции в заданных условиях и позволяет рассчитать равновесный состав реагирующих веществ, при этом рассматриваются только начальное и конечное состояния системы, а развитие реакции во времени (ее скорость и механизм) не исследуются. В общем случае нельзя считать, что чем дальше реагенты находятся от состояния равновесия, то есть, чем отрицательнее ∆rG0, тем быстрее оно будет достигнуто; между скоростью движения равновесия и его положением никакой однозначной зависимости нет.
Так для реакции: 2NO(г) + O2(г) = 2NO2(г); ∆rG0298 = - 70 кДж
2Н2(г) + O2(г) = 2Н2O(г); ∆rG0298 = - 447 кДж,
первая реакция в отличии от второй протекает очень быстро при указанной температуре (250С). Если термодинамические данные свидетельствуют о невозможности протекания реакции, то есть если ∆G > 0, то бессмысленно реализовать ее при данных условиях. Но и в том случае, когда согласно расчету процесс принципиально осуществим (∆G < 0), он может не идти из-за каких-либо препятствий на его пути. Что делать в подобных, весьма многочисленных, случаях? Ответ один – все усилия надо направить на решение проблемы скорости, на преодоление кинетических трудностей реализации процесса. Если исходя из «энергоспособности» (∆Н) и «работоспособности» (∆G), любой процесс можно представить записью:
исходные реагенты → продукты реакции (1), то есть рассчитать его, то куда сложнее обстоит дело с точки зрения течения его во времени, когда приходится расшифровывать запись.
Исходные реагенты → промежуточные продукты (переходное состояние) → продукты реакции (2).
Раскрытие механизма процесса, не представляющего интереса с точки зрения вычисления значений ∆Н, ∆S, ∆G, является очень сложной проблемой.
Исследование течения реакции во времени составляет содержание химической кинетики. Иными словами, предметом химической кинетики является исследование закономерностей протекания химических процессов во времени (их скоростей в зависимости от ряда факторов – температуры, давления, концентраций) и механизмов химических реакций (отдельных стадий и промежуточных веществ).
Прикладное значение кинетики определяется тем, что для практического использования или изучения какой-либо реакции необходимо уметь управлять ею, то есть знать ее скорость в данных условиях и способы изменения этой скорости.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Что же понимают под «термином» скорость химической реакции?
Скорость химической реакции определяется числом молей, реагирующих в единицу времени, в единице объема для гомогенных реакций и на единице поверхности раздела фаз для гетерогенных. Оба эти определения можно записать:
Vгом = 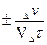 (2.1)
(2.1)
Vгетер = 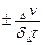 (2.2)
(2.2)
Первое выражение можно упростить. Отношение количества вещества (v) к объему (V) представляет собой молярную концентрацию (С) данного вещества:
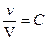 или
или 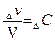
Следовательно,
Vгом = 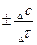 =
= 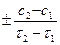 (2.3)
(2.3)
Такую скорость называют средней скоростью, а так как концентрация вещества меняется мгновенно, то можно говорить о скорости в данный момент времени и такую скорость называют истинной скоростью и ее записывают как производную от концентрации реагирующего вещества или продукта реакции по времени
V = 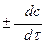 (2.4)
(2.4)
Так как с течением времени концентрация реагирующего вещества уменьшается, поэтому перед дробью ставят знак минус, так как скорость реакции есть величина положительная. Знак «плюс», если скорость определяется увеличением концентрации продукта реакции. Причем следует отметить, что выражение (2.1) справедливо как в случае переменного, так и постоянного объема, а (2.3) и (2.4) только в случае постоянного объема.
Однако для реакции, например, образования аммиака N2 + 3H2 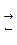 2NH3, совершенно очевидно, что в единицу времени убыль водорода втрое превышает убыль азота. Следовательно, скорость, измеренная по изменению концентрации азота, не равна скорости, измеренной по изменению концентрации водорода. Чтобы избежать подобной неоднозначности введены два понятия: скорость реакции по данному веществу
2NH3, совершенно очевидно, что в единицу времени убыль водорода втрое превышает убыль азота. Следовательно, скорость, измеренная по изменению концентрации азота, не равна скорости, измеренной по изменению концентрации водорода. Чтобы избежать подобной неоднозначности введены два понятия: скорость реакции по данному веществу
V = 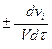 (
(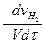
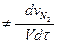 ) (2.5)
) (2.5)
И скорость реакции в целом (просто скорость данной реакции)
V = - 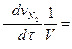 -
- 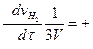
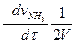 (2.6)
(2.6)
или в общем случае для реакции
v aA + v bB + v cC +... → v dD + v eE +...
V = - 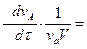 -
- 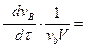 -
- 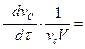 +
+ 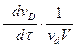 = +
= + 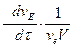 (2.7)
(2.7)
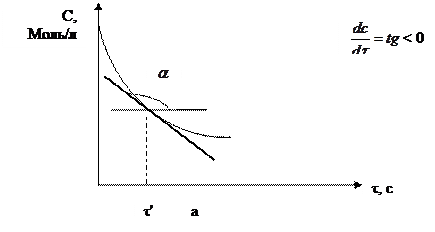
Графически скорость реакции выражается tg угла наклона касательной в точке кинетической кривой С = f(τ), соответствующей выбранному моменту времени.
 |
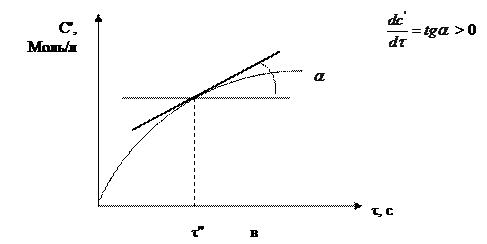 |
Рис. 2.1 Кинетические кривые: а – для исходных веществ,
в – для продуктов реакции.
В каких единицах должна выражаться скорость химической реакции?
Из определения скорости реакции следует, что она должна иметь размерность (конц. * время -1). А так как концентрацию выражают в моль/л, а время в секундах (или в минутах), то скорость выражают (моль*л-1*с-1) или (моль*л-1*мин-1). Скорость реакции зависит от очень многих факторов. На нее влияют: природа и концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, степень измельчения (в реакциях с участием твердых веществ), среда (для реакций в растворах), форма сосуда (в цепных реакциях), интенсивность света (в фотохимических реакциях), потенциал электродов (в электрохимических реакциях), мощность дозы излучения (в радиационных процессах).
Основными параметрами, которые приходится учитывать почти во всех процессах, являются концентрация (давление) реагентов, температура и действие катализаторов. Поэтому, главной задачей будет рассмотрение их влияния на скорость процесса и в дальнейшем решение вопроса, на сколько быстро с их помощью можно достичь равновесия в реагирующей системе.






