Из анализа выведенных уравнений изотермы химической реакции следует, что если значения начальных концентраций или парциальных давлений веществ соответственно равны равновесным их значениям, то максимальные полезные работы A'maxV или A'maxp равны нулю. Это значит, что при равновесном состоянии не будет осуществляться в явном виде ни прямая, ни обратная реакция, т. е. система будет находиться в динамическом равновесии.
Общее выражение зависимости константы равновесия от температуры:
d In K/dT = Q/RT2. (217)
Заменив натуральные логарифмы на десятичные и подставив значение универсальной газовой постоянной R, получим
d lg K/dT = Q /19,147 · 103 T2.
Из анализа полученных уравнений зависимости константы равновесия от температуры следует, что с повышением температуры константа равновесия увеличивается в процессах, сопровождающихся поглощением теплоты (Q > 0), т. е. в эндотермических процессах. В экзотермических реакциях (т. е. когда Q < 0) константа равновесия при понижении температуры увеличивается.
В общем случае влияние на изменение химического равновесия различных факторов (главным образом температуры и давления) подчиняется принципу смещения равновесия (принцип «Ле Шателье—Брауна»), рассмотренному выше.
§ 10. ВЫВОД УРАВНЕНИЙ ВИДА ln K = f(T) и А'max = φ(T)
Уравнения изохоры и изобары химической реакции, полученные в дифференциальной форме, могут быть проинтегрированы, что позволяет получить зависимость вида ln К = f (Т), которая позволит определить константу равновесия при любых заданных температурах. В уравнении d In K/dT = Q/RT2 для упрощения расчетов принимаем Q = const. Тогда после интегрирования
ln К = —Q/RT + С,
где С — константа интегрирования. Для небольшого температурного интервала, где можно предположить, что Q не зависит (или мало зависит) от температуры, это уравнение может быть использовано для решения конкретных задач с точностью, приемлемой для практических расчетов:
 .
.
Заменяя натуральные логарифмы на десятичные и подставляя значение R, получим
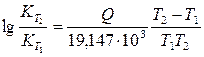 (218)
(218)
Уравнение (218) дает возможность вычислить по данным значениям констант 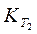 , и
, и 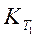 в определенном температурном интервале значение теплоты реакции Q и, наоборот, рассчитать для этого интервала константу равновесия К2, если известна теплота реакции и константа равновесия K1.
в определенном температурном интервале значение теплоты реакции Q и, наоборот, рассчитать для этого интервала константу равновесия К2, если известна теплота реакции и константа равновесия K1.
Однако, как известно, теплота реакции также зависит от температуры. Тогда в общем случае при подстановке вместо Q значения Q = f (Т) уравнение константы равновесия как функции температуры К = f (T) принимает вид
d ln K/dT = Q/RT2 = (Q0 + αT + βT2 + γT3)/RT2
или
d ln К = Q0 dT/RT2 + αdT/RT + βdT/R + γT dT/R.
Интегрируя, получим
 (219)
(219)
где С — константа интегрирования.
Подставив в уравнение (219) значение R и переведя натуральные логарифмы в десятичные, получим
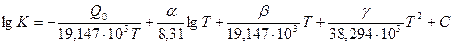 . (220)
. (220)
Уравнения (219) и (220) позволяют определить константу равновесия, если известны Q0 и константа интегрирования С. Однако определить константы интегрирования теоретическим путем, используя первый и второй законы термодинамики, невозможно, поэтому уравнение в таком виде решить не удается.
Для вывода уравнения A'mах = φ(Т) воспользуемся уравнением константы равновесия (219) и работы в функции от температуры (214).
Подставив в уравнение (214) значение ln К, получим уравнение вида A'max = φ(Т), т. е.
 (221)
(221)
или, заменив A'mах на ΔF0 или на ΔG0, a Q0 на ΔU0 или на ΔH0,
 (222)
(222)
и
 . (223)
. (223)
Уравнения (221)—(223), так же как и уравнение (219), дают возможность определить при данной температуре максимальную полезную работу реакции, изменение энергии Гельмгольца и энергии Гиббса (или меру химического сродства). При этом нужно знать также ΔU0 и ΔH0 и константу интегрирования С.
18






