Выразим энергию Гиббса в функции от Т и р. Подставим в уравнение G = H —TS вместо величин H и S их значения, выраженные через Т и р. Из уравнения (16) находим

Определим dS из уравнения (88):
dS = 1fT (dU + pdV) (140)
Здесь dU = μcVdT, a pdV найдем из характеристического уравнения, предварительно продифференцировав его:
pdVμ + Vμdp=R dT,
откуда
pdVμ = RdT – Vμ = RdT – Vμdp = RdT – RTfp dp.
Подставляя полученные выражения в уравнение (140), имеем

После интегрирования

где 5°—энтропия вещества в состоянии, принимаемом за стандартное. Окончательно получим
 (141)
(141)
Для отдельного компонента газовой смеси
Gi0 = Gi(T) + RTlnp (142)
а так как (135) Gi0 = μi, то химический потенциал i-го компонента смеси идеальных газов можно представить в виде
μi = μi(T) + RTlnpi, (143)
где pi — парциональное давление i-гo газа; μi (T) — часть химического потенциала, зависящая от температуры (и от природы газа).
Можно химический потенциал выразить также через концентрацию i-гo компонента; для этого нужно заменить рi на его значение, выраженное через концентрацию. Из характеристического
уравнения piV = niRT находим pi = nifVi RT = CiRT,
где Ci = nifVi — киломольно-объемная концентрация; ni Vi — соответственно число киломолей и объем компонента смеси. Тогда
μi = μi(Т) + RT In С + RT In (RT)
или, включив величину RT In (RT), представляющую собой функцию от температуры, в состав величины μi(T) и обозначив μi(Т) + RT In (RT) через 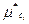 (T), получим
(T), получим
 (144)
(144)
Если в уравнение (143) подставить значение парциального давления, выраженное через объемную долю pi =riр, то уравнение будет иметь вид
μi= μi*(T) + RT In ri + RT In p. (145)
Объединив в уравнении (145) члены, зависящие от температуры и давления, и обозначив сумму через μri (T, р), получим зависимость химического потенциала i-го газа, выраженную через объемные доли в виде
μi = μr (Т,р) + RTlnri. (146)
Аналогично, заменив pi на nipfn (так как VifV = nifn), имеем

Объединив в этом выражении члены, зависящие от температуры и от объема
μi(Т) + RT ln RTfV=  (T, F), получаем
(T, F), получаем
μi =  (T,V) + RT ln ni. (147)
(T,V) + RT ln ni. (147)
ФУГИТИВНОСТЬ И АКТИВНОСТЬ
Приведенные уравнения, как было обусловлено выше, справедливы для идеальных газов. Для реальных же газов они не пригодны.
Однако, по предложению Льюиса (1901 г.) распространился метод использования этих уравнений для реальных газов при введении в них термодинамических величин: фугитивности (или летучести) f и активности а, первая из которых характеризует давление, а вторая — концентрацию. Под фугитивностью (или летучестью) подразумевают термодинамическую величину данного газа, взятого отдельно, или в составе газовой смеси, являющуюся функцией температуры, давления и состава газовой смеси и обладающую тем свойством, что отношение значений ее для различных состояний этого газа при Т = const связано с соответствующими значениями его химического потенциала соотношением
 (148)
(148)
а абсолютное ее значение определяется равенством
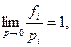
где р —общее давление; pi —парциальное давление газа i, определяемое через киломольную его долю:
pi = riр.
Размерность фугитивности совпадает с размерностью давления. Фугитивность идеального газа равна его давлению (f = p).
Таким образом, для реальных газов и их смесей будут справедливы термодинамические соотношения идеального газа для изотермических процессов при замене в них давлений соответствующими значениями фугитивности.
Например, химический потенциал i-гo компонента смеси реальных газов можно представить в виде
μi = μi(T) + RT ln fi
или максимальную полезную работу расширения реального газа в виде
 (149)
(149)
Следовательно,
ΔG = Gi – Gi0 =  (150)
(150)
Применение фугитивностей оказалось удобным в связи с тем, что были найдены способы определения их через параметры, которые сравнительно легко измерить. Например, для случая, когда можно считать, что реальный газ отличается от идеального незначительно, фугитивность может быть определена по соотношению
f/p = p/pид
где р —давление газа; рид —давление газа, принятого за идеальный, рид = RT/Vμ при заданных Т и Vμ.
Отношение фугитивности к давлению идеального газа называется коэффициентом фугитивности γ, показывающим степень отличия газа от идеального:
γ = f/pид.
При исследовании термодинамических свойств реальных газов с помощью фугитивностей принято пользоваться их значениями для газов в стандартном состоянии. Стандартным состоянием принято считать такое состояние идеального газа, фугитивность которого при данной температуре равна единице, а энтальпия равна энтальпии реального газа при той же температуре и давлении, равном нулю. Изменение энергии Гиббса можно представить в виде
ΔG = G – G0 =  =RT ln f, (151)
=RT ln f, (151)
так как для стандартного состояния f 0 = 1.
Другой термодинамической величиной, которую принято подставлять в уравнения, связывающие свойства реального газа является активность. Различают абсолютную и относительную термодинамические активности (последнюю принято называть просто активностью).
Абсолютная активность является безразмерной величиной, определяемой для вещества i в данной фазе (растворе) равенством
In λi = μi/RT, (152)
где μi — химический потенциал i-гo вещества при данной температуре.
Относительная термодинамическая активность является безразмерной величиной, определяемой для i-гo вещества в данной фазе равенством
ai = λi/λi0 (153)
или
In ai = (μi — μi0)/RT. (154)
Относительная активность также зависит от концентрации каждого из веществ, содержащихся в фазе, от температуры и давления. Для стандартного состояния аi0 = 1. При подстановке значений активности вместо значений концентрации в уравнения, выражающие связь различных термодинамических свойств идеального газа с его концентрацией, возможно применение этих уравнений к реальному газу.
Из уравнения (148) активность можно выразить через фугитивности:
ai = fi/fi0. (155)
Так как для газов fi0 = 1, то, следовательно,
ai = fi.
Подставляя в уравнение (144) значение активность вместо значения концентрации, получим соотношение для химического потенциала в виде
μi = μiai (T) + RT ln ai (156)
или, подставляя значение активности вместо значения фугитивности в уравнение (150), получим уравнение энергии Гиббса
Gi – Gi0 = RT ln ai. (157)
Отношение величины активности компонента к величине, характеризующей концентрацию компонента в данной газовой смеси, называют коэффициентом активности
φi = ai/ri, (158)
где ri — объемная или мольная доля.






