Термодинамическим потенциалом называется характеристическая функция, убыло которой в равновесном процессе, протекающем при постоянном значении соответствующих параметров, равна максимальной полезной работе, произведенной системой. Максимальная полезная работа А'mах равна максимальной работе Amах за вычетом работы против сил внешнего давления.
Рассмотрим эти потенциалы. Воспользуемся объединенным уравнением первого и второго законов термодинамики в общем виде для обратимого процесса, в котором полная работа будет максимальной:
TdS = dU + δAmax = dU + pdV + δA’max. (114)
Если за независимые переменные принять S и V, то уравнение (114) примет вид
-dU = δA'max
или
-ΔU= А'mах, (115)
т. ё. уменьшение внутренней энергии в обратимом процессе при S и V — const равно максимальной полезной работе δAmах = δA’max, следовательно, внутренняя энергия является термодинамическим потенциалом.
Приняв за независимые переменные S и р, из уравнения (114) получим
— (dU + pdV) = δA’max или —d (U + pV) = δA'max.
Заменив (U + pV) на H, после интегрирования имеем
-ΔH= А'max p (116)
т. е. уменьшение энтальпии в обратимом процессе при S = const и р = const равно максимальной полезной работе процесса. Следовательно, энтальпия является также термодинамическим потенциалом.
Определим работу при независимых переменных V и Т. Запишем объединенное уравнение первого и второго законов термодинамики для обратимого процесса в виде
TdS =dU + δАmax,
откуда
-(dU - TdS)=  ;
;
-d(U-TS)=  .
.
После замены (U—TS) на E и интегрирования получим
-ΔF =  , (117)
, (117)
откуда следует, что уменьшение энергии Гельмгольца в обратимом
изохорно-изотермическом процессе равно максимальной работе.
Приняв за независимые переменные р и Т из объединенного
уравнения первого и второго законов термодинамики, получим
— (dU + pdV — T dS) = 
или
-d(U + pV-TS) =  .
.
Заменив (U + pV) на H, а (H — TS) на G, имеем
—dG = 
или
-ΔH =  , (118)
, (118)
откуда следует, что уменьшение энергии Гиббса в обратимом изобарно-изотермическом процессе равно максимальной полезной работе  .
.
Из уравнений (102) и (110) следует, что в обратном изотермическом процессе изменения энергии Гельмгольца в энергии Гиббса для 1 кмоль газа
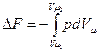
и

Заменив в этих выражениях р и Vμ из характеристического уравнения Менделеева—Клапейрона
pVμ = RT на соответствующие значения, получим изменение энергий Гельмгольца и Гиббса, а следовательно, и максимальной полезной работы в зависимости от давления и объема для изотермического процесса:
 Из уравнений (119) и (120) следует, что при изотермическом процессе для идеального газа изменения энергии Гельмгольца и энергии Гиббса одинаковы, т. е. ΔF = ΔG.
Из уравнений (119) и (120) следует, что при изотермическом процессе для идеального газа изменения энергии Гельмгольца и энергии Гиббса одинаковы, т. е. ΔF = ΔG.
§ 7. УРАВНЕНИЯ ГИББСА—ГЕЛЬМГОЛЬЦА
Заменив в уравнениях (101) и (109) значение 5 через производные характеристических функций F и G для двух состояний газа и вычитая одно уравнение из другого, получим приращение энергии Гельмгольца и энергии Гиббса в виде

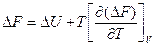 (121)
(121)
и
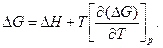 (122)
(122)
Уравнения (121), (122), связывающие энергию Гельмгольца и энергию Гиббса с их производными по температуре для процессов при V и Т = const и р и Т = const, называются уравнениями Гиббса—Гельмгольца.
заменив ΔF и ΔG на 
 и
и  , на Qv и ΔH на Qp и поменяв у всех членов знаки на обратные, уравнения Гиббса Гельмгольца можно записать в следующем виде:
, на Qv и ΔH на Qp и поменяв у всех членов знаки на обратные, уравнения Гиббса Гельмгольца можно записать в следующем виде:

В табл. 3 приведены характеристические функции и их производные.
Таблица 3 Характеристические функции и их производные
| Независимые переменные | Характеристические функции | Выражения для работы через характеристические функции | Частные производные х ар актеристических функций | Соотношения между частными производными параметров | |
| V, S | Внутренняя энергия U | 
| 
| 
| |
| p,S | Энтальпия H = U + pV | 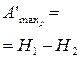
| 
| 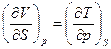
| |
| Т, V | Энергия Гельмгольца (изохорно-изотермический потенциал) F = U — TS | 
| 
| 
| |
| p, Т | Энергия Гиббса (изобарно-изо-термический потенциал) G = H — TS | 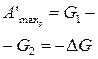
| 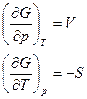
| 
|
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
При рассмотрении взаимосвязи между термодинамическими потенциалами и параметрами системы предполагалось, что масса системы неизменна. И тогда для определения состояния системы достаточно было принять две независимые переменные величины. Если же в системе изменяется состав компонентов или вещество переходит из одной части системы в другую (что имеет место при химических реакциях или при изменении агрегатного состояния), то для определения состояния всей системы необходимо рассматривать каждую ее часть в отдельности, а в число независимых переменных включать еще состав смеси.
Термодинамические потенциалы каждой части такой системыf могут быть представлены как функции двух переменных и числа киломолей всех веществ, входящих в систему. Например, энергия U =f (S, V, nl, n2,..., nk) или G = f (p, Т, n1, n2,..., nk). Предположим, что при изменении числа киломолей какого-нибудь вещества на dn1 значение энергии Гиббса изменится на беско-
нечно малую величину 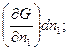 изменение числа киломолей других компонентов также повлечет за собой изменение энергии Гиббса на соответствующие величины.
изменение числа киломолей других компонентов также повлечет за собой изменение энергии Гиббса на соответствующие величины.
Тогда полный дифференциал dG, согласно уравнению (110)
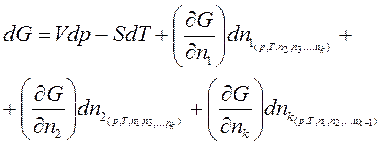 (125)
(125)
Частные производные, входящие в уравнение (125), Гиббс (1875 г.) назвал химическими потенциалами. Гиббс химический потенциал относил не к одному киломолю, а к единице массы.
Химическим потенциалом каждого компонента называется частная производная энергии Гиббса по изменению числа киломолей, этого компонента (nt) при неизменном числе киломолей всех остальных компонентов и при,р и Т = const.
Обозначим частные производные через μh тогда соответственно для первого, второго и i-го веществ
 (126)
(126)
Тогда алгебраическая сумма произведений химического потенциала каждого данного вещества на изменение числа киломолей этого вещества μ1dn1 + μ2dn2 +… μkdnk

Следовательно, полный дифференциал энергии Гиббса (125) можно записать в виде

или
 При условии протекания процесса (реакции) при р = const и Т = const получим
При условии протекания процесса (реакции) при р = const и Т = const получим
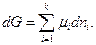 (129)
(129)
Аналогичным образом можно выразить согласно (88), (95), и (102) полные дифференциалы других термодинамических потенциалов, представляющих собой функции двух определенных независимых переменных и числа киломолей веществ, входящих в систему.
Так, при V = const, 5 = const и nl, n2,..., nk = const имеем
 (130)
(130)
при р = const, 5 = const, n2, n3,..., nk = const
 (131)
(131)
при V = const, T = const и n2, n3,..., nk = const
 (132)
(132)
Нетрудно убедиться, что μi для каждого из веществ, входящих в термодинамическую систему, будет представлять собой частную производную от соответствующего термодинамического потенциала по изменению числа киломолей этого вещества при постоянных значениях определенных параметров системы и постоянных числах киломолей остальных веществ, т. е.
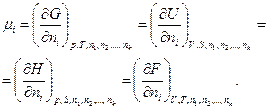 (133)
(133)
Таким образом, из (133) следует, что химический потенциал может быть выражен через частную производную от любого термодинамического потенциала (G, F, U, Н) при постоянных значениях соответствующих независимых переменных и числах киломолей всех веществ (кроме одного) по числу киломолей изменяющегося вещества, т. е. через парциальные значения этих потенциалов (отнесенные к киломолю вещества). Например:
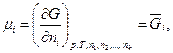 (134)
(134)
где Gi — парциальное киломольное значение энергии Гиббса. Определить физический смысл химического потенциала можно, если проанализировать уравнения изменения термодинамического потенциала в общем виде, например изменение внутренней энергии из (114) и (125):
dU = TdS – pdV - δA'max;

t=i
Здесь максимальную полезную работу δA'max, если ее рассматривать как результат изменения состава смеси в процессе химического превращения, можно представить аналогично тому, как принято представлять количество энергии — в виде произведения двух физических величин — интенсивной и экстенсивной (9). Количество энергии, получаемое в форме механической работы, например, представляют как δL == pdV, а количество энергии, получаемое в форме теплоты, как
δQ = TdS, а в форме электрической энергии δAЭЛ = Ede.
В приведенных соотношениях р, Т и Е —интенсивные величины — потенциалы механической работы, теплоты, электрической работы соответственно, а V, S и е — экстенсивные величины.
В соответствии с уравнениями (114). и (125)
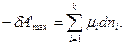
Здесь по аналогии μi — интенсивная величина — представляет собой потенциал химической работы, а ni —экстенсивная величина, количество кмоль превращающейся массы вещества.
Если системы (или части одной системы) с различными потенциалами взаимодействуют между собой, то потенциалы выравниваются при изменении экстенсивных величин. Потенциалы, таким образом, являются движущей силой соответствующих процессов. Химический потенциал является движущей силой при химических или фазовых превращениях — при перераспределении массы системы.
Потенциалы во взаимодействующих системах (частях системы) стремятся к выравниванию, приводящему систему к равновесию. Химический потенциал также по мере протекания химического процесса (или фазового превращения) выравнивается и становится одинаковым во всех частях термодинамической системы.
В общ м случае химический потенциал любого t-ro компонента является функцией состава системы и условий существования системы, например μi = f (p, T, n1 n2,..., nk).
Для идеального газа или для смеси идеальных газов принимается, что химические потенциалы компонентов не зависят от их содержания в системе и для каждого компонента смеси идеальных газов, находящихся при р — const и Т = const, химический потенциал равен значению энергии Гиббса, приходящейся на 1 кмоль компонента, взятого в стандартном состоянии, т. е.
μi = Gi0 = const. (135)
Для всей смеси идеальных газов энергия Гиббса
 (136)
(136)
Продифференцировав полученное выражение, получаем
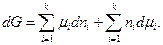 (137)
(137)
Подставим в уравнение (137) вместо dG равное ему выражение из (110). После преобразований получим
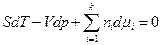 (138)
(138)
Это уравнение называется уравнением Гиббса—Дюгема. При условии протекания процесса при р и Т = const оно имеет вид
 (139)
(139)






