Примем за независимые переменные V и S. Тогда внутренняя энергия будет функцией этих переменных V =f(V, S). Так как дифференциал внутренней энергии является полным дифференциалом, то
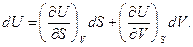 (89)
(89)
Сравнив уравнения (88) и (89), можем записать
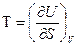 (90)
(90)
и
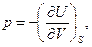 (91)
(91)
т. е. через первые производные характеристической функции U (по переменным V и S) определяются недостающие параметры системы (90) и (91).
Вторая производная от V (S, V) дает следующее:
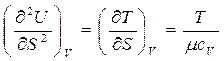
(так как 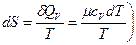 , откуда теплоемкость при постоянном объеме
, откуда теплоемкость при постоянном объеме
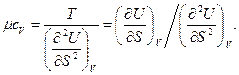 (92)
(92)
Если уравнения (90) и (91) продифференцировать вторично по другой переменной, то
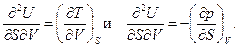
Поэтому
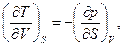 (93)
(93)
Уравнение (93) связывает термические и калорические соотношения системы.
ЭНТАЛЬПИЯ И ЕЕ ЧАСТНЫЕ ПРОИЗВОДНЫЕ
Примем за независимые переменные р и S, тогда энтальпия будет функцией переменных
Н = f (p, S). Полный дифференциал этой функции
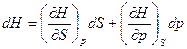 (94)
(94)
Преобразуем объединенное уравнение (88). Прибавив к обеим частям равенства Vdp, получим
dU + Vdp = TdS —pdV + Vdp
или
dU + Vdp + pdV = TdS + Vdp.
Откуда
d (U + pV) = T dS + Vdp.
Так как U + pV = H, то уравнение можно записать в виде
dH = TdS + Vdp. (95)
Сравнивая уравнения (94) и (95), находим
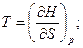 (96)
(96)
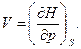 (97)
(97)
Вторая производная от Н (S, р)
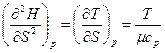
(так как dS = δQpfT = μcpdTfT) откуда теплоемкость при постоянном давлении
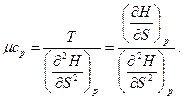 (98)
(98)
Продифференцировав вторично уравнения (96) и (97) по другой переменной, получим
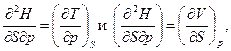
откуда получаем уравнение, связывающее термические и калорические соотношения
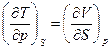 (99)
(99)
или
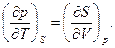 (100)
(100)
Следовательно, через первые производные характеристической функции Н (S, р) определяются термические параметры системы по независимым переменным р и S, а через вторые — калорическая величина μcp.
ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА
(ИЗОХОРНО-ИЗОТЕРМИЧЕСКИЙ ПОТЕНЦИАЛ)
Примем за независимые переменные V и Т из обеих частей равенства объединенного уравнения первого и второго законов термодинамики, записанного в виде dU —TdS = —pdV. Вычтем из обеих частей равенства SdT:
—SdT + dU —TdS = —pdV —SdT,
откуда
d(U — TS) = —pdV — SdT.
Величина (U—TS) зависит от функций состояния U и S и, следовательно, она является также функцией состояния. Ее называют энергией Гельмгольца или изохорно-изотермическим потенциалом. Эта функция в переменных V и Т является характеристической функцией и обозначается буквой F:
F = U —TS. (101) (101)
Подставив F в полученное выше уравнение, можно записать
dF = —pdV —SdT. (102)
Так как эта функция обладает свойствами полного дифференциала, запишем его значение в частных производных по независимым переменным V и Т:
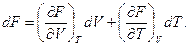 (103)
(103)
Сравнивая уравнения (102) и (103), получаем термические параметры, выраженные через первые производные функции F по независимым переменным V и Т
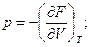 (104)
(104)
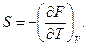 (105)
(105)
Через вторую производную можно получить калорическую величину — теплоемкость μcv, т. е.
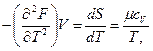
откуда
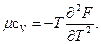 (106)
(106)
Вторые производные по второй переменной
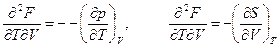
позволяют получить соотношение между термическими и калорическими величинами
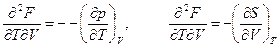
Если в уравнении (102) вместо члена — pdV (работы против сил внешнего давления) подставить внешнюю работу А, то получим
dF = — δА —SdT.
Потому для изотермического процесса (Т = const)
dF = —δА, (107)
а для изохорно-изотермического (V = const и Т — const)
dF == — δА’ = — δA, (108)
так как δA =δA' + pdV.
Таким образом, энергия Гельмгольца (F) является той частью внутренней энергии (F = U — Ts), которая может быть превращена во внешнюю работу А при обратимом изотермическом процессе или в работу против немеханических сил при изохорно--изотермическом процессе, взятых с обратным знаком.
Величина TS = U — F называется связанной энергией. При Т = const связанная энергия не может быть превращена в работу, а превращается только в теплоту.
ЭНЕРГИЯ ГЙББСА (ИЗОБАРНО-ИЗОТЕРМИЧЁСКИЙ ПОТЕНЦИАЛ)
Примем за независимые переменные р и Т. В объединенном уравнении вида
dU + pdV —TdS =0
прибавим к обеим частям равенства величину Vdp — S dT. Тогда
dU + pdV — TdS + Vdp — SdT = Vdp — S dT.
После преобразований имеем
d (U — TS + pV) = Vdp — SdT.
Заменив выражение в скобках на Н — TS, получаем
d (H — TS) = Vdp — SdT.
Величина Н—TS является функцией состояния; а переменные р и Т — характеристическими функциями. Функция состояния обозначается буквой G и называется энергией Гиббса или изобарно-изотермическим потенциалом:
G = H — TS. (109)
Заменив (H — TS) на G, можно записать
dG = Vdp —SdT. (110)
Дифференциал dG также будет полным. Представим его в частных производных по независимым переменным р и Т:
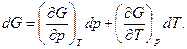 (111)
(111)
Из уравнений (110) и (111) получим
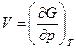 , (112)
, (112)
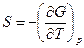 (113)
(113)
Следовательно, по функции G через ее первые частные производные при независимых переменных Т и р можно определить недостающий параметр системы V и функцию S.






