Для определения зависимости теплового эффекта реакции от температуры продифференцируем уравнения (44) и (46):
 (52)
(52)
Так как выражения  и
и 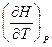 для идеальных газов представляют собой теплоемкости при V = const и р = const, то в приведенных выше соотношениях члены
для идеальных газов представляют собой теплоемкости при V = const и р = const, то в приведенных выше соотношениях члены  ,
, 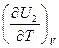 и
и 

являются суммарными изохорными и изобарными киломольными теплоемкостями(μcV1 и μсV2) и (μcP1 и μcР2) системы до и после реакции.
Подставляя значения теплоемкостей в уравнения (52), можем записать
δQV/dT = μсV2 - μcV1;
δQp/dT = μcР2 - μcP1 (53)
и в общем виде
δQ/dT = μсV - μc1 = Δμc (54)
Отношения δQVfdT и δQpfdT называются температурными коэффициентами теплового эффекта изохорной и изобарной реакций соответственно.
Приведенные соотношения (53) и (54) выражают закон Кирхгофа, который устанавливает, что температурный коэффициент теплового эффекта изохорной реакции равен разности суммарных изохорных теплоемкостей продуктов реакции и исходных веществ, а температурный коэффициент теплового эффекта изобарной реакции равен разности суммарных изобарных теплоемкостей продуктов реакции и исходных веществ.
Уравнение закона Кирхгофа в интегральной форме

Если температуру T1 принять равной абсолютному нулю, то уравнение Кирхгофа для процессов, протекающих при V = const и р = const, можно записать так
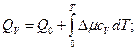

или в общем виде
 (55)
(55)
где Q0 — тепловой эффект реакции при T1 = 0. Из уравнения (54) следует, что характер кривой Q = f (Т) зависит от знака приращения теплоемкостей Δμc.
Рис. 11. Зависимость теплового эффекта реакции от температуры и приращения теплоемкостей

При Δμc > 0 (рис. 11) тепловой эффект реакции с повышением температуры растет, при Δμc < 0 убывает, а при Δμс = О остается постоянным.
§ 8. УРАВНЕНИЕ ВИДА Q = f (Т)
Для вывода уравнения зависимости теплового эффекта от температуры Q = f (Т) необходимо в уравнении (54) раскрыть величину Δμс. Запишем реакцию вида nbВ + ndD = пеЕ + ngG, где nb, nd, пе и ng — количества кмоль веществ В, D, Е и G.
Определим суммарные мольные теплоемкости исходных (В и D) веществ и продуктов реакции (Е и G).
Если принять зависимость теплоемкости от температуры вида (17), то суммарная теплоемкость исходных веществ
μc1=μcB+μcD,
где μcB=nb(ab+bbT+cbT2+…) и μcD=nd(ad+bdT+cdT2+…),
а суммарная теплоемкость продуктов реакции
μс2 =μcE + μcG,
где μсE = nе (ае + beT + ceT2 +…)
и μcG = ng (ag +bg Т + cgT2 +…).
Подставляя значение теплоемкостей в уравнение (54) после соответствующих преобразований получим
δQfdT = (n eae + ngag — nbab — ndad) + (nebe + ngbg — nbbb — ndbd) T+
+ (nece + ngcg — nbcb – ndcd) T2
или

откуда
 .
.
Проинтегрировав это выражение, найдем Q:

Если принять T = T0,то можно найти значение постоянной интегрирования Q0 = const. Тогда уравнение в общем виде

Обозначим 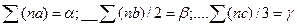 . Тогда уравнение Q = f (T) примет окончательный вид:
. Тогда уравнение Q = f (T) примет окончательный вид:
Q=Q0 + αT + βT2 + γT3 + … (56)
Если принять зависимость теплоемкости от температуры как степенную функцию из уравнения (18), то после подстановки и соответствующих преобразований получим
Q = Q0 + αT + βT2- γ’fT, (57)
где γ' = Σ(nc’).
Приняв зависимость μc = f(Т) в общем виде μc =а + bТ + сT2 + с'fT2, можно, объединив уравнения (56) и (57), записать
Q = Q0 + αT + βТ2 + γT3 - γ'fT. (58)
Полученные уравнения дают возможность определять тепловые эффекты химических процессов при V = const и p = const при любой заданной температуре, если известны зависимости теплоемкостей μcv и μcp исходных веществ и продуктов реакции от температуры и тепловой эффект Q0 данной реакции. Q0 можно определить, если известен тепловой эффект данной реакции при какой-либо температуре, из соотношений
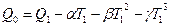
или

Тепловой эффект Q2 реакции при заданной температуре и известном Q1 при какой-либо температуре определяется по формуле, которую можно получить, решая совместно уравнения
Q1=Q0 + αT1 + βT12 +γT13
и
Q2 =Q0 + αT2 + βT22 + γT23
Вычитая из второго уравнения первое, получим
Q2 – Q1 = α(T2 – T1) + β(T22 – T12) + γ(T23 – T13). (59)
Уравнение (59) имеет большое практическое значение, так как с его помощью можно подсчитать тепловой эффект реакции для таких условий, при которых экспериментально его определить трудно или невозможно.
Важное значение для практики имеет также уравнение для подсчета теплового эффекта реакций по значениям средних теплоемкостей, изменением которых в небольших интервалах температур можно пренебречь:

откуда
 (60)
(60)
где μс1, μc2, Δμc — средние суммарные мольные теплоемкости исходных веществ и продуктов реакции в пределах температур от Т1 до T2, соответственно и их приращение.




