МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Івано-Франківський національний технічний
Університет нафти і газу
Кафедра хімії
Г.А. Романко, П.Д. Романко,
Л.Я. Побережний
ХІМІЯ
НАВЧАЛЬНИЙ ПОСІБНИК
(приклади і розв’язки)
Для студентів нехімічних інженерних спеціальностей
Івано-Франківськ
Івано – Франківський національний технічний
Університет нафти і газу
Г.А. Романко, П.Д. Романко,
Л.Я. Побережний
ХІМІЯ
(приклади і розв’язки)
НАВЧАЛЬНИЙ ПОСІБНИК

МВ 02070855- -2005
Романко Г.А., Романко П.Д., Побережний Л.Я. Хімія: Навчальний посібник. - Івано-Франківськ: Факел, 2005.- 289 с.
Посібник складений з 13 тем у відповідності з навчальним планом та програмою для студентів нехімічних інженерних спеціальностей.
Завдання і тести, приклади розв’язків та відповіді на них, узагальнюючі схеми і таблиці сприятимуть творчому усвідомленню матеріалу та формування відповідної системи хімічних знань.
У посібнику використані терміни й поняття, що відповідають найновішим поглядам і вимогам в галузі хімічних знань, вдало підібрано ілюстративний матеріал, текст викладено у доступній і зрозумілій формі.
Посібник рекомендовано для самостійної роботи.
Рецензент: канд. техн. наук, доц. кафедри хімії ІФНТУНГ, Челядин Л. І.
Дане видання власність ІФНТУНГ.
Забороняється тиражувати та розповсюджувати.
МВ 02070855- -2005
Романко Г.А., Романко П.Д., Побережний Л.Я. Хімія: Навчальний посібник. - Івано-Франківськ: Факел, 2005.- 289 с.
Посібник складений з 13 тем у відповідності з навчальним планом та програмою для студентів нехімічних інженерних спеціальностей.
Завдання і тести, приклади розв’язків та відповіді на них, узагальнюючі схеми і таблиці сприятимуть творчому усвідомленню матеріалу та формування відповідної системи хімічних знань.
У посібнику використані терміни й поняття, що відповідають найновішим поглядам і вимогам в галузі хімічних знань, вдало підібрано ілюстративний матеріал, текст викладено у доступній і зрозумілій формі.
Рецензент: канд. хім. наук, доц. кафедри хімії
ІФНТУНГ, Челядин Л. І.
Голова навчально-методичного
об’єднання спеціальності „Технологія
машинобудування” Ю.Д. Петрина
Завідувач кафедри хімії П.Д. Романко
Член експертно-рецензійної
комісії інституту фундаментальних
дисциплін П.Д. Романко
Нормоконтролер О. Гургула
Коректор Н. Будуйкевич
Дане видання - власність ІФНТУНГ.
Забороняється тиражувати та розповсюджувати.
ЗМІСТ
| Тема 1 | Атомно – молекулярне вчення | |
| Тема 2 | Будова ядер і електронних оболонок атомів хімічних елементів | |
| Тема 3 | Періодичний закон і періодична система Д.І. Менделеєва | |
| Тема 4 | Класи неорганічних сполук | |
| Тема 5 | Хімічний зв’язок і будова молекули. Ступінь окиснення | |
| Тема 6 | Комплексні сполуки | |
| Тема 7 | Окисно-відновні реакції | |
| Тема 8 | Швидкість хімічних реакцій. Хімічна рівновага | |
| Тема 9 | Енергетика хімічних реакцій | |
| Тема 10 | Розчини. Розчинність. Електролітична дисоціація. Концентрація розчинів | |
| Тема 11 | Гідроліз солей | |
| Тема 12 | Загальні відомості про метали. Метали і їх сплави | |
| Тема 13 | Основні положення електрохімії | |
| Перелік рекомендованих джерел | ||
| Додатки | ||
| Додаток А | ||
| Додаток Б | ||
| Додаток В | ||
| Додаток Г | ||
| Додаток Д | ||
| Додаток Ж |
Тема 1 АТОМНО – МОЛЕКУЛЯРНЕ ВЧЕННЯ
Приклад 1. Сформулювати основні положення атомно– молекулярного вчення (див. додаток А - Ж).
Відповідь:
Сучасним уявленням найбільше відповідають такі положення:
- Речовини мають дискретну будову. Вони складаються з молекул, атомів, електронів, йонів, тощо (структурних елементів речовини).
- Частки речовин (молекул, атоми та йони) безладно, неперервно рухаються.
- Між складовими частками речовини (молекулами, атомами та йонами) діють сили взаємного притягання та відштовхування.
- Молекули складаються із атомів, а ті в свою чергу мають свою складну будову.
- Між складовими частками речовини є певні відстані.
- Молекули зберігаються під час фізичних процесів і руйнуються під час хімічних.
- Атоми зберігаються під час хімічних реакцій – при цьому відбувається їх перегрупування, що призводить до утворення нових речовин.
- Різноманітність речовин обумовлене різними сполученнями атомів, внаслідок чого можуть виникати речовини молекулярної (утворені молекулами) і немолекулярної будови (утворені атомами та йонами).
Приклад 2. Дайте визначення основним поняттям атомно – молекулярного вчення „молекула”, „атом”, „хімічний елемент”, „проста та складна речовина”, „алотропія”.
Відповідь:
Молекула – це здатна до самостійного існування найменша частка речовини, що зберігає хімічні властивості цієї речовини.
Назва поняття походить від латинського moles – маса.
Як реальні частки, молекули мають розміри та масу. Розміри молекул становлять 10-10 – 10-7 м. У воді масою 18 г міститься 6,02 ∙ 1023 молекул, а маса однієї молекули води дорівнює 2,99 ∙ 10-26 кг.
Кількісною характеристикою молекули є відносна молекулярна маса.
Атом – це хімічно неподільна електронейтральна частка речовини, що складається з позитивно зарядженого ядра та негативно заряджених електронів.
Назва поняття походить від грецького atomos – неподільний.
Атоми – реально існуючі матеріальні об’єкти, що характеризуються певними масою, розмірами, складом, зарядом ядра, будовою електронної оболонки тощо.
Так, маса атома водню дорівнює 1,67 ∙ 10-27 кг, дубнію 4,32 ∙ 10-25 кг. Радіуси атомів становлять близько 10-10 м.
Кількісними характеристиками атома є заряд ядра (протонне число) та відносна атомна маса. Ці величини вказані в періодичній системі хімічних елементів.
Атоми позначаються хімічними знаками (символами).
Хімічний елемент – це вид атомів з однаковим зарядом ядра (протонним числом).
Поняття „хімічний елемент” не слід ототожнювати з поняттям „речовина”. Він є складовою частиною речовин. Прості і складні речовини – це форми існування хімічних елементів. Носієм властивостей хімічного елемента є атом.
Основною кількісною характеристикою елемента є заряд ядра його атомів, що збігається з порядковим номером елемента в періодичній системі. Немає різних хімічних елементів, які мали б однаковий заряд ядер атомів. Тому, знаючи заряд ядра, можна визначити, який це елемент.
Відносна атомна маса теж є кількісною характеристикою елемента, але за її значенням не можна точно визначити хімічний елемент. Існують атоми різних елементів, які мають однакові значення атомної маси, ізобари, наприклад  К і
К і  Са. Крім того є атоми одного і того ж елемента з різними атомними масами – ізотопи (
Са. Крім того є атоми одного і того ж елемента з різними атомними масами – ізотопи ( 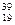 К і
К і  К). Кожний елемент має кілька ізотопів (природних і штучних). Тому в періодичній системі наведено середню атомну масу елементів з урахуванням їх поширення в природі.
К). Кожний елемент має кілька ізотопів (природних і штучних). Тому в періодичній системі наведено середню атомну масу елементів з урахуванням їх поширення в природі.
Прості та складні речовини. Усі речовини за складом поділяються на прості та складні.
Простими називаються речовини, що складаються з одного елемента, тобто це – форма існування хімічного елемента у вільному стані.
Складними називаються речовини, що складаються з різних елементів, тобто це – форма існування хімічних елементів у зв’язаному стані.
Так, кисень О2, озон О3, залізо Fe, барій Ba, хлор Cl2 – прості речовини, а вода H2O, хлоридна кислота HCl, етанол C2H5OH – складні.
Налічується більше 500 простих речовин і більше 10 млн. складних. Число простих речовин перевищує число елементів (їх ≈110), пояснюється явищем алотропії.
Алотропія – це явище існування хімічного елемента у вигляді двох або кількох простих речовин, відмінних за властивостями. Такі речовини називаються алотропними формами або модифікаціями.
Приклади алотропних модифікацій елементів:






