Аминогруппа относится к числу наиболее мощных заместителей 1 рода; она способствует реакциям электрофильного замещения в бензольном кольце и новые заместители направляет в о - и п -положения.
Влияние аминогруппы на реакционную способность бензольного кольца связано с делокализацией положительного заряда в σ -комплексе, образующемся в лимитирующей стадии реакции электрофильного замещения

Происходит это благодаря вкладу особенно устойчивой предельной структуры IV в резонансном гибриде. В структуре IV каждый атом окружен октетом электронов (соблюдается правило октетов) и, кроме того, атом азота принимает на себя заряд σ -комплекса.
При проведении реакции электрофильного замещения с участием ароматических аминов приходится учитывать две их особенности.
Во-первых, аминогруппа слишком активирует бензольное кольцо и из-за этого возникают проблемы с управлением ходом реакции. Так, при галогенировании анилина трудно получить продукты моногалогенирования, т.к. сразу образуется тригалогенид. Поэтому в ряде случаев возникает необходимость в некоторой дезактивации аминогруппы. Достигается это ацилированием ароматического амина. Преобразование аминной группы в ациламинную группу снимает излишнюю активность первой, сохранив при этом порядок ориентации. После проведения реакции замещения ациламинную группу гидролизуют (защита аминогруппы и снятие защиты)
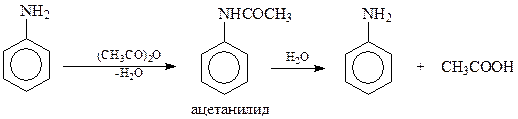
Отметим также, что защита аминогруппы предохраняет ароматическое кольцо от окисления.
Во-вторых, в реакциях электрофильного замещения с участием кислот (азотной и серной кислот) ароматические амины ведут себя как основания

В противоположность аминогруппе, NH3+-группа проявляет мощное дезактивирующее действие на бензольное кольцо, и новые заместители направляет в м -положения.
17.2.4. Галогенирование. Хлорирование или бромирование ароматических аминов протекает со значительной скоростью. При этом атомы галогена занимают все свободные о -, п -положения бензольного кольца

Однако галогенирование с защитой аминогруппы позволяет вводить в кольцо только один атом галогена

17.2.5. Нитрование. Для того чтобы при нитровании ароматических аминов можно было управлять процессом, предотвратить окисление и образование иона анилиния, реакцию проводят с защитой аминогруппы

17.2.6. Сульфирование. При взаимодействии анилина с серной кислотой образуется бисульфат анилиния, который при нагревании до 200оС превращается в сульфаниловую кислоту

Сульфаниловая кислота проявляет свойства не характерные для соединений, содержащих свободные амино- и сульфогруппы. Подобно солям сульфаниловая кислота имеет высокую температуру плавления и нерастворимость в органических растворителях. Оказалось, что она действительно существует в виде внутренней соли, поскольку она содержит в своей молекуле кислый (SO3H) и основный (NH2) остатки, которые реагируют друг с другом с образованием диполярного иона (цвиттер-иона)

При рассмотрении ароматических кислот уже отмечалось, что амиды сульфаниловой кислоты представляют интерес для медицины. К сульфаниламидам относятся, например, такие известные бактериостатические лекарства как белый стрептоцид и альбуцид

Замещенные сульфамиды обычно получают по следующей схеме

Соли диазония
Соли диазония имеют общую формулу
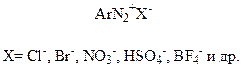
По своему строению арилдиазониевые соли подобны аммониевым солям; их можно рассматривать как ониевые соединения молекулы азота

В действительности положительный заряд несет каждый из атомов азота в диазокатионе

В растворе соли диазония полностью диссоциированы, такие растворы электропроводны.
Соли диазония достаточно неустойчивы. Среди них более устойчивы соединения, в которых в качестве противоионов к диазокатиону выступают анионы сильных кислот.
В названии солей диазония присутствует название радикала ароматического соединения и название аниона. Вот некоторые примеры

Методы получения
Основным методом получения солей диазония является реакция первичных ароматических аминов с азотистой кислотой (Грисс, 1858 год). Эту реакцию называют диазотированием. Из-за неустойчивости азотистой кислоты ее обычно получают по ходу опыта из нитрита натрия и какой-нибудь минеральной кислоты, чаще всего соляной или серной кислоты.
При диазотировании азотистая кислота в кислой среде образует несколько диазотирующих агентов

При взаимодействии с аминами диазотирующие агенты образуют нитрозамины

Нитрозамины в кислой среде через диазогидрат превращаются в соли диазония

Поскольку соли диазония чувствительны к повышению температуры, диазотирование проводят при температуре не выше 5оС и стремятся их растворы использовать немедленно после получения.
Отметим, что имеются и другие, менее распространенные, методы получения солей диазония.
Химические свойства
Самое характерное свойство солей диазония – это та легкость, с которой они замещают свою диазогруппу на подходящую нуклеофильную группу

В сочетании с реакцией диазотирования это дает возможность из ароматических аминов получить многие другие ароматические соединения

Реакции этого типа сопровождаются выделением азота, поэтому их обычно и называют «реакциями с выделением азота».
В то же время, соли диазония вступают и в реакции другого типа, когда крайний атом азота диазониевого типа реагирует с нуклеофильным реагентом без выделения азота

Этот тип превращений получил название «реакции без выделения азота» или азосочетания.
Наконец, являясь сильнейшим электроноакцепторным заместителем, диазогруппа способствует нуклеофильному замещению в ароматическом кольце.
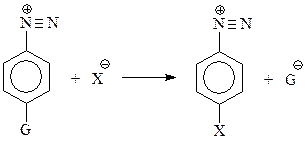
Происходит это аналогично бимолекулярному замещению ароматически связанного галогена.
Рассмотрим реакции солей диазония более подробно.






