Нитрование ароматических соединений – основной путь получения нитросоединений. Процесс нитрования как частный случай электрофильного замещения в ароматическом ряду был уже рассмотрен раньше. Поэтому представляется целесообразным сосредоточить внимание на синтетических возможностях этой реакции.
Достаточно легко и с хорошим результатом нитруется уже сам бензол

В более жестких условиях способен нитроваться и нитробензол с образованием м -динитробензола

Из–за дезактивирующего влияния двух нитрогрупп ввести третью нитрогруппу в м -динитробензол удается лишь с большим трудом. 1,3,5-Три- нитробензол был получен с выходом 45% в результате нитрования м -динитробензола при 100-110оС и продолжительности реакции 5 суток.
Трудности получения тринитробензола прямым нитрованием бензола привели к разработке косвенных методов. По одному из них более доступный, чем тринитробензол, тринитротолуол окисляется до 2,4,6-тринитробензойной кислоты, которая легко декарбоксилируется при нагревании в воде

Точно также к косвенным методам приходится прибегать и при необходимости получения 1,2-динитробензола. В этом случае обычно используется способность аминогруппы окисляться до нитрогруппы в о -нитроанилине
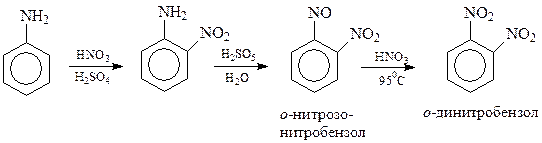
Даже в тех случаях, когда получение нитросоединений нитрованием не должно было бы встретить особых затруднений, приходится обращаться к косвенным методам. Так, не удается получить пикриновую кислоту нитрованием фенола, т.к. азотной кислотой фенол не нитруется, а окисляется. Поэтому обычно используется следующая схема
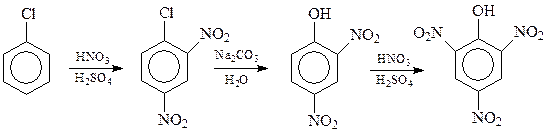
Тонкости данной схемы в том, что из-за дезактивации кольца хлором и двумя уже имеющимися нитрогруппами, не удается вводить в него третью нитрогруппу. Поэтому хлор в динитрохлорбензоле предварительно замещается на гидроксил, чему нитрогруппы как раз способствуют (бимолекулярное замещение). Образовавшийся динитрофенол легко принимает еще одну нитрогруппу, не окисляясь в заметной степени. Имеющиеся нитрогруппы предохраняют бензольное кольцо от окисления.
Еще одним неочевидным способом получения пикриновой кислоты является сульфирование фенола до 2,4-фенолдисульфокислоты с последующим нитрованием образовавшегося соединения. При этом одновременно с нитрованием происходит замещение сульфогрупп на нитрогруппы
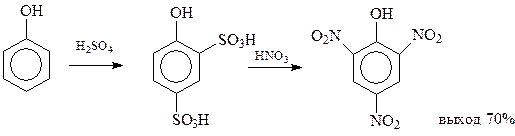
Один из важнейших ароматических нитропроизводных – тринитротолуол в технике получают нитрованием толуола, которое протекает по следующей схеме

Химические свойства
Ароматические нитросоединения способны реагировать как с участием бензольного кольца, так и нитрогруппы. Указанные структурные элементы влияют на реакционную способность друг друга. Так, под воздействием нитрогруппы нитробензол в реакции электрофильного замещения вступает неохотно и новый заместитель принимает в м -положение. Нитрогруппа влияет не только на реакционную способность бензольного кольца, но и на поведение соседних функциональных групп в химических реакциях.
Рассмотрим реакции ароматических нитросоединений за счет нитрогруппы.
16.2.1. Восстановление. Одной из важнейших реакций нитросоединений является их восстановление до ароматических аминов, широко используемых при производстве красителей, лекарственных препаратов и фотохимикатов.
Возможность преобразования нитрогруппы в аминогруппу восстановлением нитросоединений впервые была показана Зининым в 1842 году на примере реакции нитробензола с сульфидом аммония
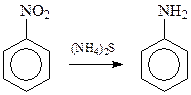
В последующем восстановление ароматических нитросоединений было предметом глубокого изучения. При этом установлено, что в общем случае восстановление носит сложный характер, протекает через ряд стадий с образованием промежуточных продуктов. Амины являются лишь конечным продуктом реакции. Результат восстановления определяется силой восстанавливающего агента и рН-среды. При электрохимическом восстановлении состав продуктов зависит от величины потенциала на электродах. Варьируя указанными факторами можно задержать процесс восстановления на промежуточных стадиях. В нейтральной и кислой средах восстановление нитробензола идет последовательно через образование нитрозобензола и фенилгидроксиламина

Когда восстановление проводится в щелочной среде, образовавшийся нитрозобензол и фенилгидроксиламин получают возможность конденсироваться между собой с образованием азоксибензола, в котором атомы азота и кислорода связаны между собой семиполярной связью

Предполагаемый механизм конденсации напоминает механизм альдольной конденсации

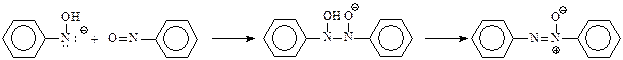
Восстановление азоксибензола в анилин идет через азо- и гидразобензолы
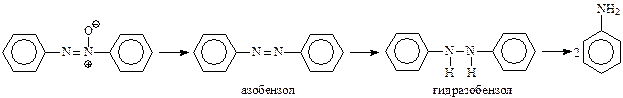
Все упомянутые выше промежуточные продукты восстановления нитробензола в анилин могут быть получены либо непосредственно из нитробензола, либо исходя друг из друга. Вот некоторые примеры
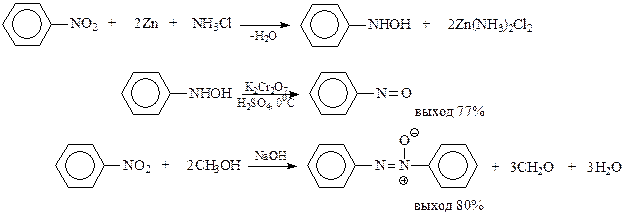

16.2.2. Влияние нитрогруппы на реакционную способность других функциональных групп. При изучении ароматических галогенпроизводных мы уже встречались со случаем, когда подходящим образом расположенная нитрогруппа (нитрогруппы) существенно влияла на нуклеофильное замещение галогена (бимолекулярное замещение ароматически связанного галогена). На примере о - и п -динитробензолов было установлено, что нитрогруппа может способствовать нуклеофильному замещению не только галогена, но даже другой нитрогруппы

Механизм бимолекулярного замещения нитрогруппы на гидроксильную группу можно представить как следующий двухстадийный процесс

Карбанион, образующийся на первой стадии рассматриваемой реакции, резонансно стабилизирован из-за вклада предельной структуры 1, в которой нитрогруппа оттягивает электроны именно с того углерода бензольного кольца, у которого их избыток.
Особенностью нуклеофильного замещения одной нитрогруппы под влиянием другой нитрогруппы является то, что реакция весьма чувствительна к расположению нитрогрупп относительно друг друга. Известно, что м -динитробензол не реагирует со спиртовым раствором аммиака даже при 250оС.
Другими примерами содействия нитрогруппы замещению, в данном случае гидроксила, являются превращения пикриновой кислоты
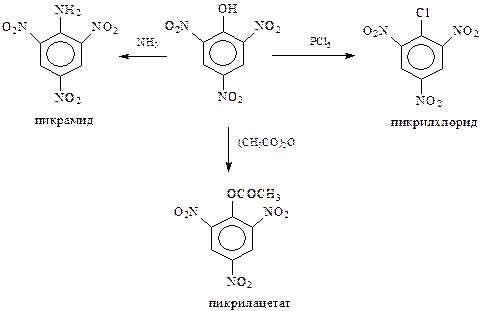
16.2.3. Комплексообразование с ароматическими углеводородами. Характерным свойством ароматических нитросоединений является их склонность образовать комплексы с ароматическими углеводородами. Связи в таких комплексах носят электростатический характер и возникают между электронодонорными и электроноакцепторными частицами. Рассматриваемые комплексы называют π -комплексами или комплексами с переносом заряда.
π –Комплексы в большинстве случаев представляют собой кристаллические вещества с характерными температурами плавления. При необходимости π -комплекс может быть разрушен с выделением углеводорода. Благодаря сочетанию указанных свойств π -комплексы используются для выделения, очистки и идентификации ароматических углеводородов. Особенно часто для комплексообразования используется пикриновая кислота, комплексы которой неправильно называются пикратами.
Глава 17
Амины
По степени замещения водородных атомов в аммиаке на алкильные и арильные заместители различают первичные, вторичные и третичные амины. В зависимости от природы заместителей амины могут быть жирно – ароматическими и чисто ароматическими.
Ароматические амины называют путем прибавления окончания «амин» к названию групп, связанных с азотом. В сложных случаях аминогруппу с меньшим заместителем обозначают приставкой «амино» (N–метиламино-, N,N-диметиламино), которую прибавляют к названию более сложного заместителя. Ниже приведены наиболее часто встречающиеся амины и их названия
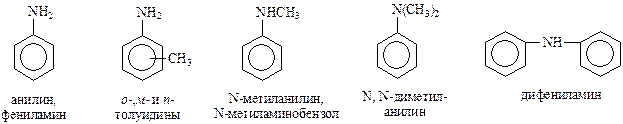
Методы получения
Со многими из методов получения аминов мы уже встречались при изучении алифатических аминов. При приложении этих методов к синтезу ароматических аминов встречаются некоторые особенности, поэтому, не опасаясь повторов, рассмотрим их.
17.1.1. Восстановление нитросоединений. Восстановление нитросоединений – основной метод как лабораторного, так и промышленного получения аминов, который можно осуществить несколькими способами. К ним относятся каталитическое гидрирование, восстановление атомарным водородом и химическое восстановление.
Каталитическое восстановление осуществляется молекулярным водородом в присутствии тонко измелченных никеля или платины, комплексных соединений меди на носителях. При выборе катализатора и условий восстановления надо иметь в виду, что при этом могут восстановиться и другие функциональные группы. Кроме того, каталитическое восстановление нитросоединений должно проводиться с соблюдением определенной осторожности из-за чрезвычайной экзотермичности реакции.
При использовании в качестве химического восстановителя сульфида аммония появляется возможность восстановления только одной из нескольких нитрогрупп
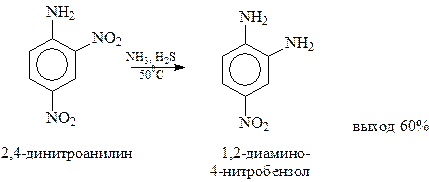
17.1.2. Аминирование галогенпроизводных. Известны трудности, которые возникают при аминировании ароматических галогенпроизводных по механизму «элиминирования – присоединения». Однако, как уже об этом говорилось не раз, электроноакцепторные заместители в бензольном кольце, расположенные надлежащим образом, значительно облегчают замещение галогена в арилгалогенидах, направляя процесс по бимолекулярному механизму. Для сравнения ниже приведены условия аминирования хлорбензола и динитрохлорбензола
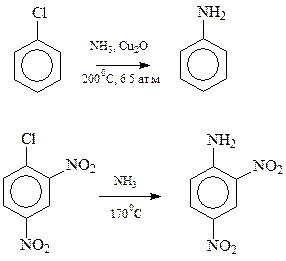
17.1.3. Расщепление по Гофману. Расщепление амидов кислот по Гофману позволяет получить первичные амины, которые содержат на один углерод меньше, чем исходные амиды

Реакция протекает с миграцией фенила от карбонильного углерода к атому азота (1,2-фенильный сдвиг) по следующему предполагаемому механизму

17.1.4. Алкилирование и арилирование аминов. Алкилирование первичных и вторичных ароматических аминов галогеналкилами или спиртами позволяет получить вторичные и третичные жирноароматические амины

К сожалению, при участии в реакции первичных аминов получается смесь. Этого можно избежать, если исходный амин предварительно проацилировать, а уже потом проалкилировать

Такой прием защиты аминогруппы позволяет получить чистые вторичные ароматические амины, а также третичные амины с разными замещающими радикалами

Арилирование аминов дает возможность получить чистые вторичные и третичные ароматические амины

Химические свойства
Ароматические амины реагируют как с участием аминогруппы, так и бензольного кольца. При этом каждая функциональная группа испытывает влияние другой группы.
Реакции по аминогруппе
Благодаря наличию аминогруппы ароматические амины вступают в многочисленные реакции. Некоторые из них были уже рассмотрены: алкилирование, ацилирование, реакция с альдегидами с образованием азометинов. Другие реакции, которым будет уделено внимание, легко предсказуемы, однако им присущи определенные особенности.
Основность
Наличие неподеленной пары электронов у атома азота, которые могут быть представлены на образование связи с протоном, обеспечивает ароматическим аминам основные свойства

Интерес представляет сопоставление основности алифатических и ароматических аминов. Как уже было показано при изучении алифатических аминов, об основности аминов удобно судить по константе основности Кв

Сравним основности анилина, метиламина и аммиака
Кв
Аммиак 1,7.10-5
Метиламин 4,4.10-4
Анилин 7,1.10-10
Из этих данных видно, что появление электронодонорной метильной группы повышает электронную плотность у атома азота и приводит к усилению основности метиламина по сравнению с аммиаком. В то же время фенильная группа более чем в 105 раз ослабляет основность анилина по сравнению с аммиаком.
Уменьшение основности анилина по сравнению с алифатическими аминами и аммиаком может быть объяснено сопряжением неподеленной пары электронов азота с секстетом электронов бензольного кольца
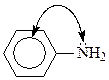
Это снижает способность неподеленной пары электронов присоединять протон. Еще более эта тенденция сказывается у ароматических аминов, которые содержат в бензольном кольце электроноакцепторные заместители

Так, м -нитроанилин как основание в 90 раз слабее, чем анилин.
Как и можно было ожидать, электронодонорные заместители в бензольном кольце усиливают основность ароматических аминов

Жирноароматические амины под влиянием алкильной группы проявляют бóльшую основность, чем анилин и амины с электроноакцепторными группами в кольце.
17.2.2. Реакция с азотистой кислотой. Особый интерес к реакции аминов с азотистой кислотой вызван тем, что она позволяет различить первичные, вторичные и третичные амины. Кроме того, в случае участия в реакции первичных аминов получаются, имеющие большое препаративное значение, соли диазония

Поскольку азотистая кислота неустойчива, ее обычно получают из ее соли и более сильной минеральной кислоты по ходу опыта

Азотистая кислота в кислой среде диссоциирует с образованием нитрозокатиона, который и реагирует с амином.
С вторичными жирно-ароматическими аминами азотистая кислота реагирует с образованием п -нитрозоаминов

Такие соединения в кислой среде перегруппировываются таким образом, что нитрозогруппа перемещается в п -положение бензольного кольца

Реакция третичных аминов с азотистой кислотой представляют собой частный случай электрофильного замещения. При этом слабый электрофил –
нитрозогруппа - вступает в бензольное кольцо в п -положение. А если оно занято – в о -положение

Восстановлением нитрозогруппа трансформируется в аминогруппу, а окислением – в нитрогруппу

Несмотря на различный результат реакции азотистой кислоты с первичными, вторичными и третичными аминами, все они идут по одной схеме – ион нитрония атакует в молекуле амина место с наибольшей электронной плотностью и замещает протон. В случае первичных и вторичных аминов – это атом азота, у третичных аминов – активированное аминогруппой п -положение бензольного кольца.
17.2.3. Окисление. Появление аминогруппы в бензольном кольце делает его крайне уязвимым к действию окислителей. Действительно, анилин легко окисляется при хранении под действием кислорода воздуха.
При окислении анилина различными окислителями получается множество соединений: азобензол, азоксибензол, нитробензол, хинон и др.
Предполагается, что в процессе окисления первоначально образуется нестабильный свободный радикал, который далее окисляется как с участием азота, так и бензольного кольца







