Наряду с органическими соединениями, содержащими в своей молекуле одно бензольное ядро, существует множество других, состоящих из двух-, трех- и более остатков бензола. Их и относят к полициклическим ароматическим соединениям. При классификации полициклических ароматических соединений учитывается не только число колец в молекуле, но и способ их соединения друг с другом. По этому признаку возможно построение молекулы из изолированных - (дифенил) или конденсированных (нафталин) бензольных колец
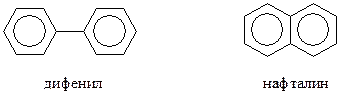
Ароматические соединения с изолированными бензольными кольцами
Простейшими углеводородами этого ряда является упомянутый выше дифенил и родственные ему соединения. Сюда же относятся и полифенилалканы
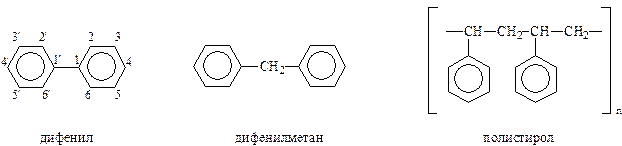
Для соединений рассматриваемого класса характерна обычная структурная изомерия. Однако в случае о, о ’-замещенных дифенилов возможен еще один, не встречавшийся до сих пор, вид изомерии. Своим существованием новый вид изомерии обязан затрудненности или даже невозможности, в определенных случаях, поворота вокруг σ -связи. Например, в дифеновой кислоте объемистые нитро- и карбоксильная группы соседних фенилов, препятствуют свободному вращению вокруг ординарной связи. В результате появляются зеркальные изомеры без асимметрического углерода. Такой вид изомерии носит название атропоизомерии

Еще в 1922 г. Кеннер и Крист и разделили изомеры дифеновой кислоты, отличающиеся только тем, что бензольные кольца в их молекуле расположены в разных плоскостях.
При составлении названий соединений дифенилового ряда используются префиксы: ди-, тер-, кватер-, квинти и т.д. Например,

Полифенилалканы рассматриваются как замещенные алканы
(С6Н5)4С (С6Н5)3С–С(С6Н5)3
тетрафенилметан гексафенилэтан
Радикал (С6Н5)2СН· – называется бензгидрилом, а (С6Н5)3С· – тритилом.
Группа дифенила
Способы получения. Имеется несколько удобных методов получения соединений ряда дифенила.
Для получения самого дифенила обычно используется термическое дегидрирование бензола, сопровождающееся конденсацией двух молекул этого углеводорода (Бертло, 1867 г.)

При получении дифенила можно исходить также из ароматических галогенпроизводных. Найдено, что для этого лучше всего подходят иодпроизводные. При их нагревании с медным порошком с высоким выходом образуются дифенилы, например,

Этот синтез с участием иодпроизводных аренов и меди носит название реакции Ульмана (1903 г.). Видно, что рассматриваемая реакция, как и реакция Фиттига – это реакция Вюрца в приложении к ароматическому ряду.
Реакция Гомберга-Бахмана, заключающаяся во взаимодействии солей диазония с бензолом в щелочной среде, позволяет получать несимметричные замещенные дифенилы
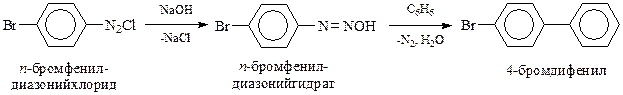
Для получения функциональных производных дифенила используются различные реакции. Так, n, п’ -диаминодифенил (бензидин), широко используемый в производстве красителей, получают бензидиновой перегруппировкой (Зинин) гидразосоединений

Получаемая из бензидина диазотированием соль диазония легко вступает в реакцию азосочетания с подходящим партнером с образованием соединений, которые относят к азокрасителям. Так, известный краситель – конго-красный – получают азосочетанием дифенилдиазониевой соли с нафтионовой кислотой

Химические свойства. До обсуждения химических свойств дифениловых соединений отметим, что бензольные кольца в этом соединении находятся в одной плоскости (копланарны). Хотя их заместители, даже водородные атомы, стремятся нарушить копланарность. Электроны бензольных колец взаимодействуют друг с другом, сопрягаются. Это приводит к существенному уменьшению длины σ -связи между бензольными ядрами. В дифениле эта связь имеет длину 0,148 нм, в то время как в этане связь между углеродами составляет 0,154 нм.
Соединения ряда дифенила по своим химическим свойствам повторяют свойства бензола и его производных. Они проявляют ярко выраженный ароматический характер и легко вступают в реакции электрофильного замещения. При этом одно бензольное кольцо ведет себя по отношению к другому как электронодонорный заместитель, т.е. как о -, п -ориентант. Однако о -ориентирование не может проявиться в полной мере из-за пространственных затруднений. Поэтому реакции хлорирования, нитрования и сульфирования идут как п -замещение. В этих реакциях новый электронодонорный заместитель вступает во второе кольцо также в п -положение, например,

В случае дифенилов, уже содержащих в качестве заместителя заместитель первого рода, второй заместитель входит в то же ядро в положение 3

Поскольку дифенил – это фенилзамещенный бензол и фенил в данном случае выступает как электронодонорный заместитель, то дифенил в реакциях электрофильного замещения более реакционоспособен, чем бензол. По этой причине реакция ацетилирования дифенила может быть осуществлена в среде бензола как растворителя.
Дифенил обладает высокой устойчивостью к нагреванию и окислению. Как уже было упомянуто, даже при 700 – 800оС как раз образуется, а не разрушается.
Хромовая кислота в среде уксусной кислоты с трудом окисляет дифенил в бензойную кислоту

В то же время, алкильные заместители в дифениле окисляются гораздо легче. Это позволяет, кроме получения соответствующих кислот дифенилового ряда, синтезировать и фенолы в результате процесса, напоминающего получение фенола и ацетона окислением изопропилбензола

Благодаря высокой термической и химической устойчивости дифенила он широко используется в качестве высокотемпературного теплоносителя.
В технике находят применение и хлорированные дифенилы. Однако следует отметить, что некоторые из них чрезвычайно токсичны.
Самым высокотоксичным ксенобиотиком признан 2,3,7,8-тетрахлор- р -дибензодиоксин. Если его токсичность принять за единицу, то токсичности некоторых полихлорированных дифенилов имеют следующие значения

Полифенилалканы
Дифенилметан. Простейшим углеводородом ряда полифенилалканов является дифенилметан. Для его получения обычно используется реакция Фриделя-Крафтса

Другим удобным способом получения дифенилметана является восстановление бензофенона, например, амальгамированным цинком в соляной кислоте
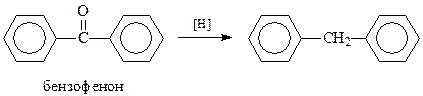
Еще один метод получения дифенилметана заключается в конденсации бензола с формальдегидом в присутствии серной кислоты

Использование в этой реакции гомологов бензола вместо бензола и других карбонильных соединений вместо формальдегида позволяет получать замещенные дифенилметаны.
Известное соединение, являющееся производным дифенилметана – кетон Михлера – получается при взаимодействии диметиланилина с фосгеном
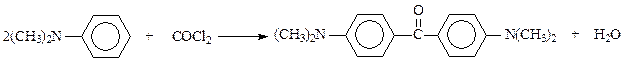
Химические свойства. По своим химическим свойствам дифенилметан ведет себя как ароматический углеводород – бензилбензол и замещенный метан.
Как ароматический углеводород дифенилметан вступает во все реакции электрофильного замещения как бензол, содержащий электронодонорный заместитель. Например,

Как и следовало ожидать, при дальнейшем нитровании вторая нитрогруппа вступает в п - и о -положения второго кольца.
Дифенилметан, как и бензол, способен к термическому дегидрированию, который сопровождается внутримолекулярной конденсацией

В отличие от дифенила, в дифенилметане имеется еще один реакционный центр в виде метиленовой группы. Некоторые реакции дифенилметана идут с участием этой группы. Так, при действии окислителей из дифенилметана получается бензофенон, при галогенировании, например, с помощью пятихлористого фосфора – дифенилхлорметан

Трифенилметан. Соединения этого ряда не просто очередная группа органических соединений. Сам трифенилметан сыграл важную роль в утверждении теории радикальных реакций, поскольку трифенилметильный радикал оказался первым известным стабильным радикалом (Гомберг, 1900 г.). Работы Гомберга убедили химиков в существовании радикалов задолго до опытов Панета и появления физико-химических методов (ЭПР) их изучения. Кроме того, производные трифенилметана составляют основу трифенилметановых красителей.
Получение трифенилметана основано на использовании реакции Фриделя-Крафтса

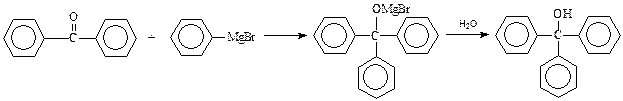
Трифенилкарбинол – производное трифенилметана, может быть получено реакцией бензофенона с фенилмагнийбромидом
Синтез трифенилметановых производных может быть осуществлен конденсацией бензальдегида с фенолами и третичными ароматическими аминами

Химические свойства. В трифенилметане влияние трех бензольных колец на метиновый водород таково, что он становится более подвижным, кислым. Это находит свое отражение как в усилении кислотных свойств трифенилметана, так и в уменьшении энергии диссоциации между метиновым углеродом и водородом. У толуола энергия диссоциации (кДж/моль) составляет 355,48, а у трифенилметана – только 314,44. Кислотности соответственно (Ка) 10-35 и 10-33.
Благодаря ослаблению С-Н-связи и усилению кислотных свойств, трифенилметан удивительным образом способен как к гетеролитическому, так и гомолитическому разрыву этой связи с образованием трифенилметильных аниона, катиона и радикала. Вот некоторые примеры

Наблюдаемый результат – это ослабление С-Н–связи в метиновой группе трифенилметана из-за влияния фенильных групп. Они могут влиять подобным образом, если только обладают электроноакцепторными свойствами. Интересно отметить, что в случае дифенила фенил, как уже об этом говорилось, выступает как донор электронов.
Хотя кислотность трифенилметана незначительна, однако он достаточно легко протонируется и под действием сильных оснований замещает свой протон на металл

Трифенилметилнатрий можно получить также под действием амальгамы натрия на углеводород в эфирном растворе.
Установлено, что трифенилметилнатрий ионно построенное соединение, в эфирном растворе проявляющее электропроводность.
Существование в составе трифенилметилнатрия и калия аниона трифенилметила объясняется стабилизацией аниона в результате рассредоточения отрицательного заряда с участием трех бензольных колец. Для примера укажем делокализацию электронов лишь с участием одного бензольного ядра

Понятно, что если бы в о - и п -положениях бензольного кольца находились электроноакцепторные заместители, то это привело бы к еще большей делокализации электронов и с участием уже и акцепторов электронов. Причем, этот путь стабилизации оказался бы более эффективным, чем стабилизация просто с участием бензольных колец.
В жидком SO2 трифенилметан электролитически диссоциирует с образованием трифенилметильного катиона, который, как и анион этого углеводорода, стабилизирован с участием трех бензольных колец

Делокализация положительного заряда в трифенилметил-катионе с участием бензольных колец происходит следующим образом (для примера покажем стабилизацию лишь с участием одного бензольного кольца)

Электронодонорные заместители в о - и п -положениях трех бензольных колец еще более стабилизируют катион. Так, содержащий три диметиламиногруппы в указанных положениях (п -диметиламинофенил)-хлорметан образует в водном растворе устойчивый катион

В этом катионе положительный заряд делокализован на трех атомах азота.
В 1900 г. Гомберг опубликовал результаты своих исследований по синтезу сполна фенилзамещенного этана с использованием реакции Вюрца

Однако, вместо гексафенилэтана, Гомберг получил какое-то вещество, которое при взаимодействии с кислородом воздуха или иодом с необыкновенной легкостью образовывал соответствующие производные. В своей публикации Гомберг отметил, что «экспериментальные данные, описанные выше, привели меня к выводу, что в данном случае мы имеем дело со свободным радикалом, трифенилметилом (С6Н5)3С»
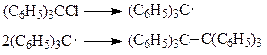
Гексаметилэтан, образовавшийся в результате рекомбинации двух трифенилметильных радикалов, находится в равновесии с гексафенилэтаном

Этот радикал легко связывается даже при 0оС кислородом воздуха и иодом
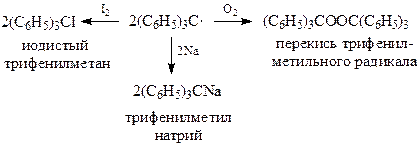
Смещение положения равновесия между углеводородом и радикалом в сторону трифенилметилового радикала объясняется двумя обстоятельствами.
С одной стороны, связь между этановыми углеродами в углеводороде, «раздираемая» шестью фенилами, значительно ослаблена. Эта связь имеет энергию диссоциации всего 46,06 кДж/моль и длину связи – 0,158 нм. Для сравнения в этане энергия связи составляет 347,52 кДж/моль, а длина связи 0,154 нм. При обсуждении рассматриваемого равновесия надо иметь в виду также стерическое препятствие сближению и установлению связи между радикалами.
С другой стороны, трифенилметильный радикал отличается значительной устойчивостью из-за возможности эффективной делокализации неспаренного электрона с участием трех бензольных колец

Ради точности необходимо отметить, что продукт рекомбинации двух трифенилметильных радикалов имеет строение не гексафенилэтана, а является 4-трифенилметил-1-дифенилметиленциклогексадиеном-2,5

Впрочем, для опытов Гомберга, впервые приведших к стабильному радикалу, это значения не имело.
Трифенилметильные соединения широко используются в качестве красителей. Как пример можно привести фенолфталеин. Этот краситель используется также в качестве весьма распространенного индикатора

Получение другого общеизвестного красителя – малахитового зеленого – заключается в конденсации бензальдегида и диметиланилина с получением бесцветного лейкооснования, который при окислении дает карбинол. Спирт при обработке кислотой превращается в окрашенную соль







