Ароматические соединения, в молекуле которых бензольные кольца имеют два общих атома углерода, называются конденсированными. Примерами таких углеводородов могут служить следующие соединения этого ряда


За этими соединениями, а также некоторыми другими, по систематической номенклатуре сохранены их тривиальные названия.
В нафталине положения 1, 4, 5, 8 обозначаются символом α, а остальные - β.
Одновалентные радикалы нафталина носят название α - и β -нафтилов.
В дизамещенных нафталинах заместители в 1 и 2 – положениях получили обозначение орто, в 1 и 3 – мета, в 1 и 4 – пара, в 1 и 8 – пери, в 2 и 6 – амфи.
Нафталин
Легкокристаллизирующийся нафталин (т.пл. 80оС) был выделен из каменноугольной смолы раньше бензола, еще в 1819 г. Гарденом. Содержание нафталина в этом источнике достигает 6% и он не потерял своего значения до наших дней. Состав нафталина был определен в 1838 г. Воскресенским, а строение установлено в 1866 г. Э рленмейером и Гребе. Приписываемое нафталину строение – два конденсированных бензольных кольца – подтверждено многочисленными синтезами и результатами физико-химических методов исследований. Однако метод доказательства, использованный Эрленмейером и Гребе, имеет познавательное значение. Поэтому он вполне заслуживает упоминания.
Эрленмейеру и Гребе было известно, что нафталин и α -нафтиламин при окислении образуют о -фталевый ангидрид, а α -нитронафталин – о -нитрофталевый ангидрид
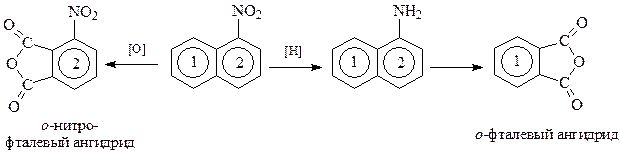
Этих данных оказалось вполне достаточно, чтобы убедиться, что оба кольца в нафталине бензольные, равноценные и связаны они в двух точках.
Строение нафталина. По современным представлениям нафталин представляет собой систему из двух бензольных колец, в которой все углероды sp 2-гибридизованы и лежат в одной плоскости. В отличие от бензола, у которого все связи между углеродами имеют одинаковую длину, в нафталине он отличаются друг от друга

То, что в нафталине связи имеют различную длину и кольца не симметричны, свидетельствует о неравномерном характере распределения электронной плотности в молекуле.
Нафталин подчиняется правилу Хюккеля для ароматических систем - 4n + 2 при n=2 и содержит 10 π -электронов.
Хотя нафталин и проявляет ароматический характер, однако он выражен в меньшей степени, чем у бензола. Как известно, бензол термодинамически более выгоден, чем гипотетический циклогексатриен на величину 150,73 кДж/моль. Можно было бы ожидать, что для нафталина, состоящего из двух бензольных колец, энергия резонанса составит величину 150,73 х2=301,46 кДж/моль. Однако резонансная энергия нафталина всего лишь 255,41 кДж/моль.
Таким образом, нафталин – ароматическая система, которая, однако, менее ароматична, чем бензол.
Не все свойства нафталина могут быть объяснены исходя из формул

Для объяснения некоторых реакций нафталина, в которые он вступает вопреки вышеприведенным формулам, изобразим его в виде резонансных структур

Из рассмотрения этих канонических формул видно, что в двух случаях из трех – II и III – на одно из колец приходится лишь две π -связи. Отсюда следует, что нафталин, с учетом вклада этих структур в резонансный гибрид, может рассматриваться как сочетание бензольного кольца с 1,3-диеновой системой. С учетом этого обстоятельства предлагалось молекулу нафталина изображать как систему, состоящую из бензола и диена
При таком подходе к строению нафталина становятся объяснимыми такие его свойства как склонность к вступлению в реакции 1,4-присоединения

Удалось осуществить с нафталином за счет его 1,3-диеновой составляющей и такую классическую реакцию как реакция Дильса-Альдера. Правда, для этого пришлось использовать сильные диенофилы в жестких условиях (более 150оС)

Способы получения. Нафталин образуется при пропускании ацетилена или же ацетилена и бензола над древесным углем при 400оС

Также как и в случае бензола, нафталиновые углеводороды могут быть получены реакцией дегидроциклизации исходя из подходящих алкилбензолов (Pt, 300оС)

Для получения нафталина можно использовать и реакцию диенового синтеза с участием диенов и бензохинона в качестве диенофила

Наиболее универсальным синтезом нафталиновых соединений является, пожалуй, метод Хеуорса, представляющийсобой сочетание реакций ацилирования, восстановления оксо-групп по Клеменсену и ароматизацию тетралина дегидрированием

Синтез Хеуорса предоставляет широкие возможности для его модификации:
- при использовании замещенных бензолов заместитель в нафталине оказывается в β -положении;
- при помощи магнийорганического синтеза с участием оксо-групп β -бензоилпропионовой кислоты и тетралона в нафталиновое кольцо можно ввести одинаковые или различные заместители;
- при использовании замещенных янтарных ангидридов появляется возможность получения 2,3-дизамещенных нафталинов.
Химические свойства. Как уже отмечалось, нафталин – ароматическое соединение. Он вступает в реакции замещения, присоединения и восстановления – окисления.
В реакциях электрофильного замещения нафталин активнее бензола. Следует только отметить, что речь идет об одном из бензольных колец – первом. Для нарушения его ароматичности требуется лишь 104,68 кДж/моль, а оставшееся кольцо реагирует уже как обычное соединение моноароматического ряда. В этом случае для нарушения ароматичности требуется уже 150,73 кДж/моль.
В отличие от бензола, у нафталина два неравноценных положения α - и β. Поэтому электрофил в общем случае мог бы занять любое из них
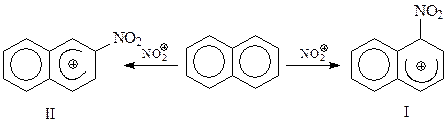
Однако оказалось, что в реакциях электрофильного замещения с участием нафталина более привлекательным является α -положение. Происходит это потому, что σ -комплекс с α -положением заместителя I оказывается более стабильным, чем другой возможный σ -комплекс II. Это хорошо видно, если эти комплексы изобразить, воспользовавшись теорией резонанса

При α -замещении σ -комплекс, представляющий собой резонансный гибрид структур III, IV и V, включает в себя две неустойчивые канонические структуры с сохранением одного бензольного кольца – III и IV. В то же время σ -комплекс, образовавшийся при β -замещении включает лишь одну стабильную предельную структуру с сохранением бензольного кольца - VI. Это обстоятельство и обуславливает большую устойчивость I по сравнению с II. Считают, что I энергетически на 41,87 кДж/моль более выгодна, чем II.
Рассмотрим теперь конкретные реакции электрофильного замещения в нафталиновом ряду.
Нитрование и галогенирование. Нафталин нитруется и галогенируется в α -положение. Реакции идут настолько легко, что, например, галогенирование протекает даже без участия катализатора

Через галоген- и нитро-производные открываются возможности для синтеза многих производных нафталина через амины и диазосоединения, а также через магнийорганические соединения.
Ацилирование. Нафталин под действием ацилирующих агентов в присутствии хлорида алюминия ацилируется. При этом место вступления остатка кислоты зависит от растворителя: в сероуглероде, тетрахлорэтане имеет место α -замещение, а в нитробензоле – в β -положение нафталиновой системы

Предполагается, что нитробензол образует как с хлористым ацетилом, так и хлоридом алюминия, комплексы, для которых α -положение нафталина менее доступно по пространственным соображениям.
Сульфирование. Результаты сульфирования нафталина зависят от температуры, при которой проводится реакция. При повышенной температуре (160оС) основным продуктом реакции является β -нафталинсульфокислота, а при более низкой температуре - α -изомер

Интересно при этом, что при нагревании до 1600С α -изомер превращается в β -изомер.
Эти факты можно объяснить тем, что при более низких температурах сульфирования накопление продуктов реакции происходит в соответствии с относительными скоростями образования изомерных кислот. Уже отмечалось, что α -положение нафталина более подвержено электрофильной атаке, т.к. в этом случае реакция идет через более стабильный σ -комплекс (кинетический контроль). При повышенных температурах накопление продуктов идет в соответствии с термодинамическими устойчивостями изомеров – здесь преимущество за β -изомером нафталинсульфокислоты (термодинамический контроль).
В случае участия в реакциях электрофильного замещения производных нафталина, место вступления нового заместителя диктуется имеющимся заместителем.
При этом электронодонорные заместители способствуют реакции и новый заместитель направляют в α -положение того же кольца

В то же кольцо вступает новый заместитель и в том случае, если в замещенном нафталине электронодонорный заместитель находится в β -положении

Электроноакцепторный заместитель в нафталине новый заместитель направляет в незамещенное кольцо в положения 5 и 8

Электроноакцепторный заместитель в нафталине в β -положении затрудняет реакцию и новый заместитель направляет в незамещенное кольцо в положения 5 и 8

Кроме рассмотренных реакций, нафталин способен к окислению и восстановлению.
Восстанавливается нафталин легче, чем бензол, даже атомарным водородом. При этом в зависимости от температуры реакции, восстановление идет в положения 1 и 4 или 1, 2, 3 и 4

При каталитическом гидрировании нафталин вначале образует тетралин, который далее может, при более жестких условиях, превратиться в декалин

Интересно отметить, что декалин существует в виде цис - и транс -изомеров. В цис -изомере водороды у общих для двух циклогексановых колец углеродов расположены в цис -положении, а у транс -изомера – в транс -положении

В зависимости от условий проведения реакции, окисление нафталина приводит к различным кислоросодержащим продуктам. При окислении оксидом хрома в среде уксусной кислоты при комнатной температуре продуктом реакции оказывается нафтахинон, а окисление бихроматом калия направляется на боковую алкильную цепь

Нафталин окисляется легче, чем бензол. Это позволяет окислить одно бензольное кольцо нафталина, сохранив другое
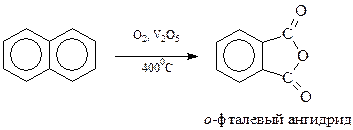
На этом основано получение о -фталевого ангидрида в промышленных масштабах.
Антрацен и фенантрен
Антрацен и фенантрен являются изомерами и отличаются лишь способом соединения трех бензольных колец между собой

Все бензольные кольца в молекулах обоих изомеров расположены в одной плоскости. Каждый из 14 углеродов антрацена и фенантрена sp 2-гибридизованы. р -Электроны этих углеродов взаимно перекрываются, образуя π -электронные облака над и под плоскостью молекулы. Резонансная энергия у антрацена (351,17 кДж/моль) ниже, чем у фенантрена (385,20 кДж/моль).
Антрацен и фенантрен соответствуют правилу Хюккеля для ароматических систем 4n+2 при n=3. Судя по длинам связей в антрацене, распределение электронной плотности в его молекуле неравномерное

Таким образом, антрацен и фенантрен являются ароматическими системами и обладают ароматическим характером, однако менее выраженным, чем в случае бензола и нафталина. Они вступают в реакции присоединения и замещения по положениям 9 и 10. Это объясняется тем, что при таком направлении атаки реагентов в промежуточных и конечных продуктах сохраняется два бензольных кольца. Во всех других случаях незатронутой остается лишь одно бензольное кольцо. Это обстоятельство и определяет направление реакции.
Для получения антрацена и фенантрена используют реакции циклизации, например,

Восстановлением антрахинона можно было бы получить сам антрацен. Однако часто в этом нет необходимости, т.к. антрахинон – более ценный исходный продукт в различных синтезах, чем сам углеводород.
При получении антрацена и фенантрена можно использовать и метод Хеуорса. Покажем это на примере синтеза фенантрена

При взаимодействии нафталина и янтарного ангидрида ацилирование может идти и по β -положению. Однако продукт этого направления реакции - β -(2-нафтоил)-пропионовая кислота – в результате приведенной выше цепочки превращений также дает фенантрен.
Химические свойства. В соответствии со строением антрацен и фенантрен проявляют ароматический характер и вступают в реакции замещения и присоединения с участием 9- и 10-положений.
В отличие от бензола и нафталина антрацен и фенантрен восстанавливаются атомарным водородом. Также легко они окисляются до соответствующих хинонов

Аналогично идут реакции и с участием фенантрена.
В случае участия в реакциях электрофильного замещения антрацена и фенантрена вначале образуются соответствующие карбокатионы, которые стабилизируются либо, отдав протон основанию (замещение), либо присоединив само основание (присоединение)
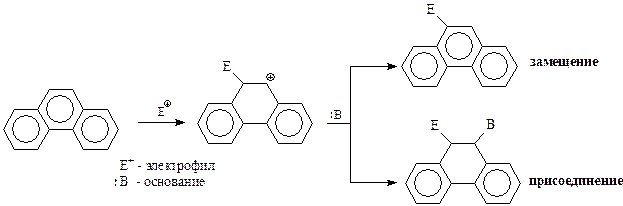
Реакции замещения с участием антрацена и фенантрена приводят к сложной и трудноразделимой смеси производных. Поэтому они не имеют пока какой-то синтетической ценности. Тем более, что многие практически важные представители производных рассматриваемых полициклов могут быть получены не из них, а в ходе их синтеза.
Антрацен и фенантрен и их производные имеют важные области применения, особенно в качестве красителей. Как общеизвестный пример приведем синтез одного из антрахиноновых красителей – ализарина. Этот краситель с давних времен добывался из природного источника – корня растения марены (краппа).
В 1868 г. Гребе и Либерман установили строение ализарина и осуществили его синтез по следующей схеме

Далее антрахинон сульфировался серной кислотой, укрепленной олеумом, во второе положение антрахинона. Полученная антрахинон-2-сульфокислота подвергалась реакции щелочного плава в присутствии окислителя (KNO3)

Ализарин, как и большинство антрахиноновых красителей, относится к протравным красителям. При этом способе крашения ткань предварительно обрабатывают раствором соли (соли алюминия, железа, хрома, меди, титана), а затем красителем. На ткани образуется нерастворимая комплексная соль (лак), цвет которого зависит от использованной соли
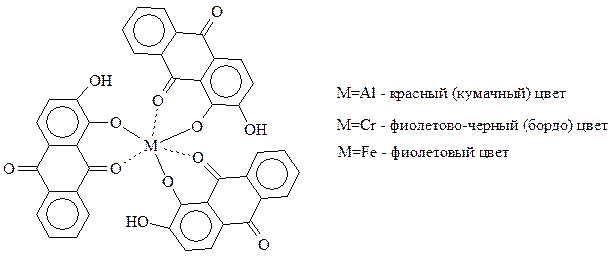
Канцерогенные углеводороды. Многие полициклические ароматические углеводороды проявляют канцерогенные свойства. Само это явление было обнаружено в 1915 г. Ямагива и Ишикава.
Было замечено, что рабочие, соприкасавшиеся с каменноугольной смолой, часто заболевают раком кожи. Ямагива и Ишикава прикладывали смолу к коже крыс и вызвали у них рак кожи. В 1933 г. из каменноугольной смолы Кук, Хьюетт и Хигеч выделили 1,2-бензпирен – вызывавший рак кожи. Одним из сильных канцерогенов является 1,2-бензантрацен, однако эталоном канцерогенной активности был выбран 3,4-бензпирен или бенз-(а)-пирен, что одно и то же

ГЛАВА 11






