5. Компактность, или отсутствие внутригенных знаков препинания. Внутри гена каждый нуклеотид входит в состав триплета, кодирующего аминокислоту. Из-за того, что между кодонами внутри гена нет знаков препинания, возможны так называемые мутации «сдвига рамки считывания». Они возникают в случае вставки или выпадения одного или двух нуклеотидов. Такие мутации приводят к полному изменению синтезируемого полипептида. При выпадении или вставке трех нуклеотидов (или количества нуклеотидов, кратного трем) сдвига рамки не происходит. При этом в полипептиде появляется или выпадает одна аминокислота, но остальные аминокислоты остаются неизменными. Поэтому вставка или удаление одного нуклеотида в начальной части гена приводят к порче всего гена. В зависимости от того, с какого нуклеотида начинается дешифровка одной и той же последовательности нуклеотидов, возможно несколько рамок считывания, внутри которых «тексты» различны (рис. 19[O19]). При этом одна и та же нуклеотидная последовательность может кодировать три совершенно различные последовательности аминокислот.
 6. Универсальность. Генетический код един для всех живущих на Земле существ. У всех существующих видов одни и те же триплеты кодируют одинаковые аминокислоты. Однако, как и в человеческих языках существуют диалекты, так и значения некоторых триплетов у разных организмов могут несколько отличаться. Например, у одной из инфузорий кодон УГА кодирует цистеин (или селеноцистеин), тогда как у подавляющего большинства остальных организмов это стоп-кодон. У всех эукариот от универсального кода отличается код митохондрий. Отличия касаются значений одного-двух кодонов. Так в митохондриях коров кодон АУА кодирует метионин, а в универсальном коде – изолейцин, а кодон УГА, являющийся терминирующим в универсальном коде, в митохондриях определяет включение триптофана. Можно сказать, что митохондрии разных видов говорят на разных языках, но никогда – на языке клетки, в которой они находятся. По-видимому, это позволяет им сохранять в клетке некоторую самостоятельность.
6. Универсальность. Генетический код един для всех живущих на Земле существ. У всех существующих видов одни и те же триплеты кодируют одинаковые аминокислоты. Однако, как и в человеческих языках существуют диалекты, так и значения некоторых триплетов у разных организмов могут несколько отличаться. Например, у одной из инфузорий кодон УГА кодирует цистеин (или селеноцистеин), тогда как у подавляющего большинства остальных организмов это стоп-кодон. У всех эукариот от универсального кода отличается код митохондрий. Отличия касаются значений одного-двух кодонов. Так в митохондриях коров кодон АУА кодирует метионин, а в универсальном коде – изолейцин, а кодон УГА, являющийся терминирующим в универсальном коде, в митохондриях определяет включение триптофана. Можно сказать, что митохондрии разных видов говорят на разных языках, но никогда – на языке клетки, в которой они находятся. По-видимому, это позволяет им сохранять в клетке некоторую самостоятельность.
7. Помехоустойчивость. Мы знаем, что все белки могут выполнять свои функции только тогда, когда они имеют определенную пространственную конформацию – третичную и четвертичную структуры. Эти структуры зависят от связей между радикалами аминокислот, входящих в этот белок. По радикалам все аминокислоты можно разделить на четыре класса: неполярные, способные к гидрофобным взаимодействиям; полярные, образующие водородные связи; отрицательно заряженные и положительно заряженные, способные к электростатическим взаимодействиям. Если в результате замены нуклеотида в ДНК в белке произойдет замена одной аминокислоты на другую, но принадлежащую к тому же классу, то структура белка, как правило, меняется незначительно, что может вообще не сказаться на выполнении функции. Замены нуклеотидов, не приводящие к смене класса кодируемой аминокислоты, называют консервативными. Замена нуклеотида, приводящая к смене класса кодируемой аминокислоты (называемая радикальной), сказывается на третичной структуре белка и, как следствие, на выполнении его биологической функции.
В каждом триплете может произойти 9 однократных замен. Общее количество возможных замен нуклеотидов в триплетах, кодирующих аминокислоты, оказывается 61 × 9 = 549. Из них 134 замены из-за вырожденности кода не меняют кодируемую аминокислоту, 230 замен не меняют класс кодируемой аминокислоты. 162 замены являются радикальными, т.е приводят к смене класса аминокислоты. Таким образом, отношение числа консервативных замен к числу радикальных замен будет (134 + 230): 162 = 2,25. Эта цифра – показатель помехоустойчивости генетического кода. Она означает, что бóльшая часть замен нуклеотидов не сказывается на третичной и четвертичной структуре белка и его функции.
8. Неперекрываемость. В 1956 г. Георгий Гамов предложил вариант перекрывающегося кода, в котором каждый нуклеотид, начиная с третьего в гене, входит в состав трех кодонов. Достоинством перекрывающегося кода является компактность, меньшая зависимость структуры белка от вставки или удаления нуклеотида. Но у перекрывающегося кода есть и существенный недостаток – бóльшая зависимость структуры белка от замены нуклеотида и ограничение на соседей. Последнее означает, что такой способ кодирования очень сильно уменьшает возможное разнообразие белков. Например, кодон ГГЦ обозначает аминокислоту глицин. В перекрывающемся коде следующий кодон будет ГЦХ. Независимо от того, какой нуклеотид обозначает буква Х, это будет аланин. Другими словами, если кодоны перекрываются, то после глицина никакая аминокислота, кроме аланина, стоять не может. Следующая аминокислота тоже не может быть любой – в зависимости от того, какой нуклеотид обозначен буквой Х, это будет одна из пяти аминокислот (а не из 20, как в неперекрывающемся коде). Это означает, что перекрывающимся кодом невозможно закодировать любую последовательность аминокислот. Когда в 1962 году генетический код был расшифрован, оказалось, что он является неперекрывающимся, т.е. каждый нуклеотид входит в состав лишь одного кодона.
 В 1976 г. была секвенирована ДНК фага φ Х 174. Было известно, что ДНК фага кодирует 9 белков. Для 7 из них были определены гены, располагающиеся друг за другом. Выяснилось, что у этого фага некоторые гены частично или полностью перекрываются. Ген В полностью находится внутри гена А, а ген Е полностью находится внутри гена D. Их инициирующие кодоны появляются в результате сдвига рамки считывания на один нуклеотид. Инициирующий кодон гена J перекрывается с терминирующим кодоном гена D в результате сдвига рамки считывания на два нуклеотида (рис. 20[O20]).
В 1976 г. была секвенирована ДНК фага φ Х 174. Было известно, что ДНК фага кодирует 9 белков. Для 7 из них были определены гены, располагающиеся друг за другом. Выяснилось, что у этого фага некоторые гены частично или полностью перекрываются. Ген В полностью находится внутри гена А, а ген Е полностью находится внутри гена D. Их инициирующие кодоны появляются в результате сдвига рамки считывания на один нуклеотид. Инициирующий кодон гена J перекрывается с терминирующим кодоном гена D в результате сдвига рамки считывания на два нуклеотида (рис. 20[O20]).
|
Информационная емкость ДНК. В наш вексуперкомпьютеров трудно удивить кого-либо объемами хранимой информации. Попробуем оценить объем информации в ДНК. На Земле живет ~6 миллиардов человек. У каждого человека ~25 тысяч генов. У всех людей ~15·1013 генов или 30·1016 пар нуклеотидов, которые составляют 1017 кодонов. Единицей генетической информации в ДНК является кодон. На долю последовательностей нуклеотидов, кодирующих белки, у человека приходится не более 1,5 % ДНК. Значит, объем информации о белках в ДНК человека составляет около одного петабайта (1015 байт). Такой объем информации вполне достижим для современных компьютеров. Какой физический объем займут разные носители такого количества информации? Средняя книжная страница содержит 25·102 знаков. ДНК 6·109 сперматозоидов (содержащих информацию о 6 миллиардах живущих на Земле людей) содержит информацию, равную по объему примерно 4·1013 книжных страниц или 13,5 миллионов DVD. 6·109 сперматозоидов – это примерно 1 мл. Их ДНК занимает менее половины миллилитра, а вся кодирующая белок часть ДНК – в 150 раз меньше. Не случайно сейчас ученые стремятся создать носители информации для суперкомпьютеров будущего на основе синтетических ДНК-подобных молекул.
§ 8. Подготовительный этап трансляции. Рибосомы.
Адаптерный принцип трансляции. Как мы знаем, все признаки любого организма, все стороны его функционирования определяются белками, входящими в его состав. И та генетическая информация, о которой мы говорили в предыдущем параграфе, предназначена для того, чтобы эти белки синтезировать. Осуществляется это в ходе трансляции – синтезе белка по матрице мРНК. Трансляция – это перевод генетической информации с языка нуклеотидов на язык аминокислот, осуществляемый в ходе синтеза белка. Поскольку нуклеотиды, из которых состоит матричная РНК, и аминокислоты, составляющие белки, – это разные по своим химическим свойствам молекулы, то матричный принцип в ходе трансляции не может осуществляться за счет комплементарности мономеров. Трансляция отличается от остальных матричных синтезов тем, что она идет с помощью адаптеров – своего рода переходников, которые и осуществляют перевод последовательности нуклеотидов в последовательность аминокислот. Этими переходниками служат транспортные РНК. Принцип их действия заключается в том, что на одном конце структуры находится антикодон – триплет, комплементарный одному из кодонов в мРНК. К другому концу присоединена аминокислота – та, которая кодируется именно этим кодоном. В результате тРНК, присоединяющиеся своим антикодоном к кодону, выстраиваются в том порядке, в котором расположены кодоны в мРНК (и, соответственно, в ДНК, откуда эта РНК была считана). И в этом же порядке, естественно, выстраиваются аминокислоты. Соединение этих выстроенных аминокислот пептидными связями и дает полипептид с закодированной последовательностью аминокислот. Таким образом, и в ходе трансляции выполняется принцип комплементарности, но, в отличие от синтеза нуклеиновых кислот, через посредство адаптера – тРНК. Для того, чтобы полипептид был построен в точном соответствии с записью в мРНК, каждая транспортная РНК должна безошибочно узнать и присоединить свою аминокислоту. Именно это и составляет суть подготовительного этапа трансляции.
Структура транспортной РНК. Для того, чтобы понять, как адаптеры и аминокислоты узнают друг друга, нужно подробнее познакомиться со структурой тРНК. Транспортные РНК – короткие молекулы, состоящие из 75-95 нуклеотидов, имеющие и вторичную, и третичную структуру (рис. 21[O21]).
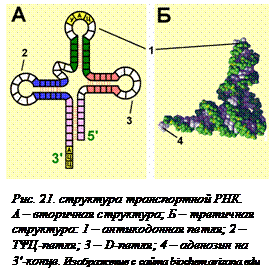 Вторичная структура (ее сравнивают с листом клевера) обусловлена водородными связями между нуклеотидами, расположенными в разных частях молекулы. Хотя тРНК – одноцепочечная молекула, в ней много двуцепочечных участков. Они образуются за счет палиндромов, разделенных непалиндромными участками. Эти участки образуют три петли. Последовательность нуклеотидов ЦЦА на 3'-конце одинакова для всех тРНК. К концевому аденозину (А) присоединяется та аминокислота, которую переносит эта транспортная РНК. На вершине антикодонной петли находится антикодон – последовательность трех нуклеотидов, комплементарная кодону в информационной РНК. В состав транспортных РНК входят несколько минорных (см. § 5) нуклеотидов. В так называемой TΨЦ-петле находятся тимин (T), обычно не встречающийся в РНК, и псевдоуридин (обозначается греческой буквой Ψ), который отличается от уридина тем, что в нем урацил присоединен к рибозе другим атомом. В D-петле находится дигидроуридин. Наличие этих нуклеотидов необходимо для безошибочного узнавания ферментами, присоединяющими к тРНК аминокислоту, и для защиты от действия рибонуклеаз. Рибонуклеазы не опознают содержащие необычные нуклеотиды молекулы, поэтому в отличие от мРНК транспортные РНК являются долгоживущими.
Вторичная структура (ее сравнивают с листом клевера) обусловлена водородными связями между нуклеотидами, расположенными в разных частях молекулы. Хотя тРНК – одноцепочечная молекула, в ней много двуцепочечных участков. Они образуются за счет палиндромов, разделенных непалиндромными участками. Эти участки образуют три петли. Последовательность нуклеотидов ЦЦА на 3'-конце одинакова для всех тРНК. К концевому аденозину (А) присоединяется та аминокислота, которую переносит эта транспортная РНК. На вершине антикодонной петли находится антикодон – последовательность трех нуклеотидов, комплементарная кодону в информационной РНК. В состав транспортных РНК входят несколько минорных (см. § 5) нуклеотидов. В так называемой TΨЦ-петле находятся тимин (T), обычно не встречающийся в РНК, и псевдоуридин (обозначается греческой буквой Ψ), который отличается от уридина тем, что в нем урацил присоединен к рибозе другим атомом. В D-петле находится дигидроуридин. Наличие этих нуклеотидов необходимо для безошибочного узнавания ферментами, присоединяющими к тРНК аминокислоту, и для защиты от действия рибонуклеаз. Рибонуклеазы не опознают содержащие необычные нуклеотиды молекулы, поэтому в отличие от мРНК транспортные РНК являются долгоживущими.
При образовании третичной структуры D- и ТΨЦ-петли складываются и вся молекула изгибается, образуя третичную структуру, в проекции на плоскость похожую на латинскую букву L. Всего может существовать не менее 61 разных (различающихся антикодонами) тРНК – столько, сколько существует кодирующих триплетов. У прокариот есть еще и специальная формилметиониновая тРНК с таким же антикодоном, как и метиониновая. Они различаются последовательностью нуклеотидов на 5'-конце и в D-петле. Разнообразие третичных структур тРНК значительно меньше – 20 (по количеству аминокислот). Имеющие разные антикодоны, но кодирующие одну и ту же аминокислоту, тРНК имеют одинаковую третичную структуру. Такие тРНК называются изоакцепторными. К ним присоединяется одна и та же аминокислота.
Рекогниция. Длятого, чтобы трансляция могла начаться, аминокислоты должны быть узнаны своими тРНК и присоединены к ним. Это происходит во время подготовительного этапа трансляции. Он называется рекогницией (recognition – узнавание). Суть рекогниции заключается в образовании ковалентной связи между тРНК и соответствующей аминокислотой (рис. 22[O22]). Рекогниция состоит из двух стадий. Первая стадия – активирование аминокислоты. Активирование представляет собой химическую реакцию присоединения аминокислоты к аденозину в составе АМФ:
аминокислота + АТФ → аминоациладенилат + пирофосфат
Вторая стадия рекогниции – аминоацилирование, заключается в переносе аминокислоты с аминоаденилата на аденозин на 3'-конце тРНК:
аминоациладенилат + тРНК → аминоацил-тРНК + АМФ
Обе стадии рекогниции осуществляются ферментом аминоацил-тРНК-синтетазой (APC-азой). APC-азы – крупные молекулы, так как они должны вместить в свои узнающие центры три другие молекулы – аминокислоту, АТФ и транспортную РНК. Существует 20 вариантов APC-аз – столько же, сколько аминокислот (селеноцистеин синтезируется особыми ферментами из серина непосредственно на специальной тРНК). Аминоацилирование – энергозависимый процесс, требующий расщепления АТФ. У каждой APC-азы три центра связывания – для аминокислоты, тРНК и АТФ. APC-азы узнают тРНК по их третичной структуре, поэтому изоакцепторные тРНК узнаются одной и той же APC-азой.
 Существует особая тРНК, которая называется формилметиониновой тРНК. Ее узнает метиониновая APC-аза, присоединяет к ней метионин, и уже после реакции аминоацилирования к метионину специальным ферментом, который узнает эту тРНК, присоединяется формил – остаток муравьиного альдегида. Именно с формилметионина начинается синтез любого полипептида у бактерий. Таким образом, кодон АУГ играет роль заглавной буквы в кодирующем полипептид участке мРНК, а формилметионин – заглавная буква в этом полипептиде.
Существует особая тРНК, которая называется формилметиониновой тРНК. Ее узнает метиониновая APC-аза, присоединяет к ней метионин, и уже после реакции аминоацилирования к метионину специальным ферментом, который узнает эту тРНК, присоединяется формил – остаток муравьиного альдегида. Именно с формилметионина начинается синтез любого полипептида у бактерий. Таким образом, кодон АУГ играет роль заглавной буквы в кодирующем полипептид участке мРНК, а формилметионин – заглавная буква в этом полипептиде.
Каждая тРНК используется в качестве переносчика аминокислоты многократно. Освободившуюся в ходе синтеза белка на рибосоме от аминокислоты тРНК АРСаза снова связывает с такой же аминокислотой.
Структура рибосом. Собственнотрансляция – синтез полипептидов, происходит на рибосомах.Рибосомы – немембранные клеточные органеллы, самые мелкие, но при этом едва ли не самые сложные (рис. 23[O23], В). Каждая рибосома состоит из двух субчастиц (большой и малой), отличающихся и рибосомными РНК и белками, образующими комплексы с рРНК (рис. 23, А). Пока рибосома не занята синтезом полипептида, она диссоциирована, субчастицы не соединены друг с другом. Синтез белков осуществляют ассоциированные рибосомы. 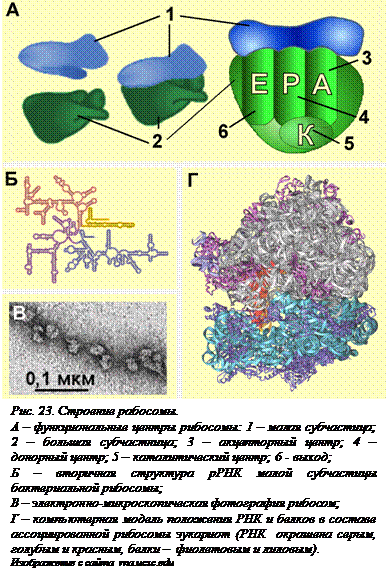
|
Таблица 3. Состав рибосом про- и эукариот
| ||||
| Бактериальная рибосома 70 S | Эукариотическая рибосома 80 S | |||
| Субчастицы | 50 S | 30 S | 60 S | 40 S |
| РНК | 5 S рРНК 23 S рРНК | 16 S рРНК | 5 S рРНК 5,8 S рРНК 28 S рРНК | 18 S рРНК |
| Белки | 31 разный белок | 21 белок | Не менее 50 разных белков | Не менее 33 разных белков |
В клетке E. сoli присутствует около 103-5·103 рибосом. Рибосомы бактерий имеют размеры 21×29 нм. Для частиц такого размера принято указывать так называемый коэффициент седиментации (константу Сведберга), обозначаемый буквой S. Он зависит от молекулярной массы и от формы частицы (широкая и плоская частица осаждается при центрифугировании медленнее, чем компактная такой же массы). Поэтому константа седиментации ассоциированной рибосомы не равна сумме констант седиментации ее субчастиц. Она меньше из-за компактной формы собранной рибосомы. Рибосомы бактерий обозначают как 70 S рибосомы. В цитоплазме эукариотических клеток находятся 80 S рибосомы, они крупнее (22 × 32 нм) и сложнее бактериальных (табл. 3). Полуавтономные органоиды эукариот – митохондрии и хлоропласты, имеют собственный аппарат белкового синтеза и, следовательно, собственные рибосомы. Самые мелкие рибосомы находятся в митохондриях животных – 55 S. Рибосомы митохондрий грибов имеют промежуточные размеры – 75 S. В хлоропластах высших растений рибосомы такие же, как у бактерий – 70 S.
В состав рибосом входят молекулы рибосомных РНК и рибосомные белки. Сложность структуры рибосом объясняется тем, что подавляющее большинство составляющих их молекул присутствует в одном экземпляре. Например, в бактериальной рибосоме только один из 31 белка большой субчастицы присутствует в количестве 4 молекул.
Долгое время считалось, что рибосомные РНК выполняют фукнция каркаса для белков. Однако сравнительно недавно было показано, что белки выполняют в рибосоме хотя и очень важные, но вспомогательные функции – они стабилизируют структуру рибосомы и увеличивают эффективность ее работы. Самое главное в работе рибосомы – реакция транспептидации (переноса аминокислоты, принесенной тРНК, на синтезирующийся пептид) осуществляет 23 S рРНК большой субчастицы. Функции других рРНК также вспомогательные – 16 S рРНК необходима для правильной установки инициирующего кодона АУГ мРНК на 30 S субъединице, 5 S рРНК – для правильной ориентации аминоацил-тРНК на рибосоме.
Все рРНК обладают очень сложной вторичной структурой. Несмотря на то, что рРНК состоят из одной цепочки, значительная часть молекулы представляет собой двойную спираль (рис. 23, Б). В результате 25-летней работы ученым удалось расшифровать положение каждого атома в составе рибосомы. В 2009 году за эту работу была присуждена Нобелевская премия. Получить наглядное представление о взаимном расположении всех молекул в ассоциированной рибосоме оказалось возможным только с помощью специальных компьютерных программ (рис. 23, Г).
В ассоциированной рибосоме можно различить несколько «рабочих» центров (рис. 23, А).
Р-центр – пептидильный, донорный. В нем находится тРНК, несущая первую аминокислоту полипептида – формилметионин у бактерий или метионин у всех остальных живых организмов. На последующих стадиях трансляции к тРНК в Р-центре присоединена уже синтезированная часть пептида. Из этого центра формилметионин, метионин или пептид переносятся в А-центр.
А-центр – аминоацильный, акцепторный. В этот центр рибосомы поступают очередные аминоацил-тРНК. В этом центре происходит акцептирование формилметионина, метионина или пептидила.
Е-центр – выход (exit). Из этого участка тРНК, освободившаяся после передачи пептидила из Р-центра в А-центр, покидает рибосому.
К-центр – каталитический. В нем происходит главное событие трансляции – возникновение очередной пептидной связи.К-центр образован 23 S рРНК большой субчастицы рибосомы. К-центр катализирует перенос пептидила из состава пептидил-тРНК на поступившую в А-центр очередную аминоацил-тРНК. При этом образуется еще одна пептидная связь и пептидил удлиняется на одно звено.
§ 9. Синтез белка на рибосоме.
После завершения подготовительного этапа начинается собственно трансляция – синтез белка на рибосоме. Как и в других матричных синтезах, в трансляции выделяют три этапа – инициацию, элонгацию и терминацию.
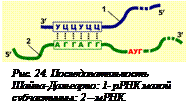 Инициация трансляции. Для того чтобы полипепептид был синтезирован правильно, считывание должно начаться со строго определенного нуклеотида в мРНК. У бактерий в каждом цистроне считываемая последовательность нуклеотидов и соответственно каждая молекула мРНК начинается с так называемой лидерной последовательности. Она является нетранслируемой, так как не кодирует аминокислот, но она нужна для того, чтобы рибосома могла узнать инициирующий кодон АУГ. Эта последовательность может быть разного размера (до 160 нукл.) и разной первичной структуры, но обязательно содержит так называемую полипуриновую последовательность Шайна-Дальгарно (обычно это шесть нуклеотидов АГГАГГ). Этот участок мРНК комплементарен участку, находящемуся на 3'-конце 16 S рРНК малой субчастицы рибосомы. Спаривание этих участков позволяет точно установить малую субчастицу рибосомы относительно кодона АУГ (рис. 24[O24]). Этот кодон находится на расстоянии 3-10 нуклеотидов от последовательности Шайна-Дальгарно. Первым этапом трансляции и является образование комплекса малой субчастицы с мРНК.
Инициация трансляции. Для того чтобы полипепептид был синтезирован правильно, считывание должно начаться со строго определенного нуклеотида в мРНК. У бактерий в каждом цистроне считываемая последовательность нуклеотидов и соответственно каждая молекула мРНК начинается с так называемой лидерной последовательности. Она является нетранслируемой, так как не кодирует аминокислот, но она нужна для того, чтобы рибосома могла узнать инициирующий кодон АУГ. Эта последовательность может быть разного размера (до 160 нукл.) и разной первичной структуры, но обязательно содержит так называемую полипуриновую последовательность Шайна-Дальгарно (обычно это шесть нуклеотидов АГГАГГ). Этот участок мРНК комплементарен участку, находящемуся на 3'-конце 16 S рРНК малой субчастицы рибосомы. Спаривание этих участков позволяет точно установить малую субчастицу рибосомы относительно кодона АУГ (рис. 24[O24]). Этот кодон находится на расстоянии 3-10 нуклеотидов от последовательности Шайна-Дальгарно. Первым этапом трансляции и является образование комплекса малой субчастицы с мРНК.
Взаимодействие малой субчастицы и последовательности Шайна-Дальгарно приводит к тому, что кодон АУГ оказывается в Р-центре, а следующий кодон – в А-центре малой субчастицы рибосомы. Но пока нет большой субчастицы, попасть в рибосому (точнее, в малую субчастицу) может только формилметионин-тРНК. Ее антикодон образует водородные связи с кодоном АУГ. Второй кодон мРНК также находится в малой субчастице, но вход в А-центр закрыт, тРНК с аминокислотой туда попасть не может. В результате образуется инициаторный комплекс: 30 S субчастица рибосомы + мРНК + формилметиониновая тРНК-формилметионин (рис. 25[O25], 1). Только после этого происходит ассоциация рибосомы, то есть присоединение большой субчастицы. При этом конформация 16 S рРНК изменяется, и связь между ней и последовательностью Шайна-Дальгарно нарушается. Это необходимо для того, чтобы рибосома могла передвигаться по мРНК.
После того, как формилметионин-тРНК заняла свое место и присоединилась большая субчастица, А-центр ассоциированной рибосомы оказывается доступным для аминоацил-тРНК. Туда входит та несущая аминокислоту тРНК, антикодон которой соответствует кодону, следующему за АУГ (рис. 25, 2). Рибосома начинает работать – формилметионин в результате действия каталитического центра рибосомы отрывается от тРНК, переносится в А-центр и присоединяется к аминокислоте, связанной с тРНК, находящейся в А-центре (рис. 25, 3). В Р-центре остается «пустая» формилметиониновая РНК. Образованием первой пептидной связи заканчивается этап инициации.
У эукариот последовательности Шайна-Дальгарно нет, у них правильная установка рибосомы обеспечивается особой структурой мРНК и участием специальных белков.
Элонгация. После образования пептидной связи рибосома передвигается на один кодон. В результате пустая формилметиониновая тРНК переходит из Р-центра в Е-центр затем покидает рибосому (рис. 25, 4). Второй кодон мРНК вместе с  тРНК, к которой теперь уже присоединен дипептид, переходит в Р-центр, а А-центр освобождается. В нем оказывается третий кодон, к которому подходит следующая аминоацил-тРНК с соответствующим антикодоном. Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-тРНК (рис. 25, 5). Удлинение полипептидной цепочки так и происходит – рибосома передвигается на один кодон, пептидил-тРНК с растущим полипептидом на конце оказывается в Р-центре, в А-центр попадает следующий триплет, напротив которого встает очередная аминоацил-тРНК. Предыдущая тРНК, освобожденная от пептидила, покидает рибосому.
тРНК, к которой теперь уже присоединен дипептид, переходит в Р-центр, а А-центр освобождается. В нем оказывается третий кодон, к которому подходит следующая аминоацил-тРНК с соответствующим антикодоном. Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-тРНК (рис. 25, 5). Удлинение полипептидной цепочки так и происходит – рибосома передвигается на один кодон, пептидил-тРНК с растущим полипептидом на конце оказывается в Р-центре, в А-центр попадает следующий триплет, напротив которого встает очередная аминоацил-тРНК. Предыдущая тРНК, освобожденная от пептидила, покидает рибосому.
Терминация. Когда в А-центр на малой субчастице попадает стоп-кодон, то А-центр ассоциированной рибосомы остается пустым, так как не существует тРНК с таким антикодоном (рис. 25, 6). Для того, чтобы было возможно завершить процесс, в А-центр приходит специальный белок, называемый рилизинг-фактором (от release – освобождать). Он занимает место аминоацил-тРНК. В Р-центре все происходит, как и раньше – полипептид отрывается от тРНК, переносится в А-центр, но присоединиться к рилизинг-фактору он не может. Поэтому он просто покидает рибосому. Рибосома диссоциирует, и малая субчастица снова соединяется с молекулой мРНК.
В организме не только на стадии терминации, но и всех остальных стадиях (образования инициаторного комплекса, начала и продолжения синтеза полипептида) участвуют различные белковые факторы, которые препятствуют посадке на рибосому «пустой» тРНК, не несущей аминокислоту, или посадке формилметиониновой-тРНК в А-центр.
Все синтезируемые полипептиды бактерий (и митохондрий эукариот) на N-конце несут формилметионин. Из всех полипептидов, синтезированных бактериальной клеткой, 80% начинается с метионина, который образуется в результате отщепления формильного радикала от формилметионина. От 20% полипептидов отщепляется и метионин.
У эукариот синтез любого полипептида начинается с образования пептидной связи между аминоацил-тРНК, соответствующей второму кодону, и метионином, который в инициаторный комплекс приносит особая «инициирующая» тРНК с антикодоном УАЦ, комплементарным АУГ.
§ 10. Посттрансляционная обработка белков
Фолдинг – сворачивание полипептида в нативную третичную структуру, является необходимым условием функционирования белка. Синтезируемые в клетке полипептидные цепи представляют собой полностью развернутые молекулы. Для того чтобы белок приобрел присущие ему функциональные свойства, цепь должна определенным образом свернуться в пространстве. Для третичной структуры каждого белка характерно определенное сочетание элементов вторичной структуры – α-спиралей, β-слоев, а также гибких участков – петель.
Процесс сворачивания протекает в несколько стадий (рис. 26, А[O26]). Сначала очень быстро образуется вторичная структура – участки α-спиралей и β-слоев. Способность того или иного участка молекулы сложиться в α-спираль, β-слой или в петлю зависит от последовательности аминокислот в молекуле. Затем также очень быстро образуются отдельные элементы третичной структуры.
Следующая стадия – медленное образование специфической пространственной конформации главным образом за счет гидрофобных взаимодействий. Так как гидрофобные взаимодействия неспецифичны, на этом этапе возможны ошибки. Это связано с тем, что могут «склеиться» гидрофобные участки разных молекул, то есть произойдет неспецифическая агрегация. Функциональный белок при этом не образуется. Чтобы предотвратить это нежелательное событие, в клетке существуют специальные белки, называемые молекулярными шаперонами и шаперонинами (английское слово chaperone близко по смыслу к слову «гувернантка», «наставница», «дуэнья»). Шапероны начинают взаимодействовать с синтезируемым белком еще до его схождения с рибосомы. Они связываются с полностью или частично развернутой молекулой белка и удерживают ее, экранируя гидрофобные группы и предохраняя ее от неспецифической агрегации. Они переносят развернутую молекулу в нужное место (например, в митохондрии или хлоропласты), помогают ей пройти, если это нужно, сквозь мембрану органоида. В цитоплазме они создают условия для эффективного правильного сворачивания (рис. 19, Б), передавая ее другому белку-помощнику – шаперонину.
Шаперонины, в отличие от просто устроенных шаперонов, представляют собой сложные белки, состоящие из большого числа субъединиц. Они похожи на стаканчик с полостью внутри (рис. 26, В). В эту полость помещается принесенная шаперонами полипептидная цепь, после чего «стаканчик» закрывается «крышечкой». Попавшая внутрь шаперонина молекула оказывается полностью изолированной и получает возможность без помех осуществить стадию медленного сворачивания. Субъединицы  шаперонина, получая энергию от АТФ, периодически меняют свою конформацию, как бы «встряхивая» содержимое «стаканчика» (рис. 26, Г), чем способствуют более быстрому протеканию этой стадии. Когда белок приобретет нативную структуру, «крышечка» открывается и готовая молекула покидает шаперонин.
шаперонина, получая энергию от АТФ, периодически меняют свою конформацию, как бы «встряхивая» содержимое «стаканчика» (рис. 26, Г), чем способствуют более быстрому протеканию этой стадии. Когда белок приобретет нативную структуру, «крышечка» открывается и готовая молекула покидает шаперонин.
Шапероны и шаперонины не только «воспитывают» только что синтезированные молекулы белка, но и «чинят» белки, третичная структура которых почему-либо нарушилась. Часто нарушение третичной структуры белка происходит в стрессовых для клетки ситуациях, например, из-за повышения температуры. При этом резко усиливается синтез шаперонов. Впервые они и были обнаружены при так называемом «тепловом шоке» клеток, поэтому их часто называют «белками теплового шока».
В результате теплового шока или других воздействий – свободных радикалов, активных форм кислорода, окисляющих дисульфидные мостики, могут возникать «незаконные сшивки», когда дисульфидные мостики восстанавливаются, но в неправильных местах. Такие нарушения третичной структуры могут исправляться с помощью специального внутриклеточного антиоксиданта – трипептида глутатиона (см. § 4).






