Коферменты обычно присутствуют в активных центрах фермента. Нередко они служат переносчиками различных групп атомов (например, остатков кислот). Многие коферменты являются производными витаминов.
Важнейшим свойством ферментов является возможность регулирования их работы. Нередко ферменты синтезируются клеткой «про запас» в виде неактивного профермента. Обычно активация профермента происходит в результате отщепления части его полипептидной цепочки, что приводит к открытию активного центра. 
Аллостерическая регуляция осуществляется за счет изменения конформации фермента в результате присоединения специальной молекулы-регулятора, называемой лигандом (лат. ligeo – связываю) к аллостерическом центру (рис. 6, Б). Некоторые сложные ферменты содержат отдельные каталитические и регуляторные субъединицы. Активация может осуществляться в результате объединения субъединиц, или, наоборот, диссоциации. Отсоединение активной каталитической субъединицы, в свою очередь, может стимулироваться аллостерически (рис. 6, В). Так как работа фермента, как уже было сказано, осуществляется за счет его трехмерной структуры, то молекулы, имеющие такую же форму, как молекула (или даже часть молекулы) субстрата, связавшись с активным центром фермента, лишает его активности. Такой способ «выключения» фермента называется конкурентным ингибированием (рис. 6, Г). Этот механизм лежит в основе действия
некоторых лекарств. Одним из распространенных способов регуляции активности ферментов является фосфорилирование. Присоединение заряженного остатка фосфорной кислоты изменяет конформацию фермента, открывая его активный центр (рис. 6, Д). Таким образом, активный центр фермента – это его «рабочий орган», самая важная часть молекулы. Действие многих ядов (цианидов, соединений ртути, мышьяка, фосфорорганических соединений) связано с тем, что они необратимо связываются с активными центрами ферментов (это так и называют – отравление активного центра), делая невозможными основные процессы жизнедеятельности.
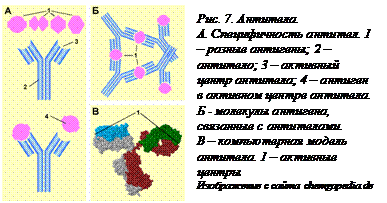 Защитная функция белков. Специальные белки иммунной системы позвоночных животных защищают их от чужеродных агентов – бактерий и вирусов, крупных экзогенных молекул, называемых антигенами. Антитела, осуществляющие реакции иммунитета, представляют собой особые белки – иммуноглобулины. Огромное разнообразие третичных структур иммуноглобулинов позволяет им распознавать любой антиген. Взаимодействуя с чужеродным соединением, антитела, находящиеся в крови, «склеивают» антигены и образуют преципитат, уничтожаемый затем фагоцитами (Рис. 7[O7]).
Защитная функция белков. Специальные белки иммунной системы позвоночных животных защищают их от чужеродных агентов – бактерий и вирусов, крупных экзогенных молекул, называемых антигенами. Антитела, осуществляющие реакции иммунитета, представляют собой особые белки – иммуноглобулины. Огромное разнообразие третичных структур иммуноглобулинов позволяет им распознавать любой антиген. Взаимодействуя с чужеродным соединением, антитела, находящиеся в крови, «склеивают» антигены и образуют преципитат, уничтожаемый затем фагоцитами (Рис. 7[O7]).
Специальные иммуноглобулины находятся на поверхности клеток животных, маркируя принадлежность клеток именно данному организму.
В ответ на заражение вирусами некоторые клетки позвоночных продуцируют интерфероны. Эти белки связываются с плазмалеммой здоровых клеток и стимулируют образование специальных ферментов, способных разрушить вирусные мРНК.
Другой тип защитной реакции организма, осуществляемый белками – выработка токсинов, которые некоторыми животными используются как белковые яды для защиты от врагов.
Регуляторная функция. В таких сложных системах, каковыми являются клетки и организмы, четкая регуляция всех происходящих в них процессов – необходимое условие жизнедеятельности. Регуляторные системы действуют и на внутриклеточном, и на тканевом, и на организменном уровнях. Регуляторные молекулы очень разнообразны по своей химической природе. Среди них значительную часть составляют регуляторные белки.
Внутри клетки белки-репрессоры и белки-активаторы транскрипции играют ключевую роль в регуляции действия генов (подробнее об этом будет сказано в параграфах 10 и 11). На организменном уровне регуляторами являются гормоны. Многие гормоны являются белками. Например, инсулин, гормон поджелудочной железы, регулирует переход глюкозы через клеточную мембрану. При недостаточной секреции инсулина у млекопитающих развивается тяжелое заболевание – сахарный диабет. Белком является соматотропин – гормон роста, образующийся в передней доле гипофиза. Там же образуется и адренокортикотропный гормон (АКТГ). Он действует на кору надпочечников, регулируя синтез небелковых стероидных гормонов.
Рецепторная функция. Эта функция белков очень тесно связана с предыдущей. Клетка или организм для того, чтобы адекватно реагировать на изменения внешней среды должны получать сигналы. Такими сигналами могут быть гормоны или нейромедиаторы, запахи, свет и т.д. Чтобы реагировать на эти сигналы, их нужно воспринять. Для этого клетки имеют рецепторы – белковые молекулы (нередко связанные с полисахаридами), реагирующие на определенный стимул – сигнальную молекулу (лиганд) или квант света. Сигнальные молекулы и рецептор подходят друг к другу как ключ к замку. Связывание молекулы лиганда изменяет пространственную конфигурацию рецептора. При этом рецептор, как правило, приобретает ферментативную активность, в результате чего в клетке запускается каскад биохимических реакций, то есть осуществляется реагирование на стимул.
§ 3. Функции белков. Продолжение
Структурная функция белков. Белки входят в состав всех без исключения клеточных органелл, как мембранных, так и немембранных. Белки являются главной структурной частью опорных и покровных тканей животных. Белки соединительной ткани составляют строму – структурную основу различных органов. Без белков не существует ни один орган, ни одна клетка, ни один клеточный органоид. Как правило, структурные белки бывают фибриллярными. Полипептидные цепочки располагаются бок о бок и скрепляются электростатическими взаимодействиями, водородными связями и/или дисульфидными мостиками. В результате образуются очень прочные нити, видимые в микроскоп или даже невооруженным глазом. Так, человеческий волос состоит из «трехжильных канатов», каждый из которых скручен из цепочек богатого цистеином a-кератина. Цепочки скреплены друг с другом дисульфидными мостиками.
Транспортная функция белков. В многоклеточных организмах для поступления определенных веществ в те клетки, которые в них нуждаются, простой диффузии недостаточно, да она и не всегда возможна. Активный перенос веществ осуществляется специальными транспортными белками. Многочисленные пермеазы – мембранные белки, переносят полярные соединения через мембрану как по, так и против градиента концентрации. Такие белки осуществляют свою функцию за счет изменения конформации (рис. 8[O8]). Специальные белки образуют постоянные каналы в плазмалемме для поступления воды. В клеточной стенке бактерий особый белок порин формирует «трубы», стенки которых образованы бета-слоями молекулы (рис 8). В кровеносном русле белок гемоглобин в составе эритроцитов переносит кислород и углекислый газ. Другие белки переносят некоторые вещества, нужные клеткам, но которые токсичны для организма. К таким веществам относятся ионы железа и меди, которые входят в состав ферментов, но в свободном виде не должны находиться в крови.
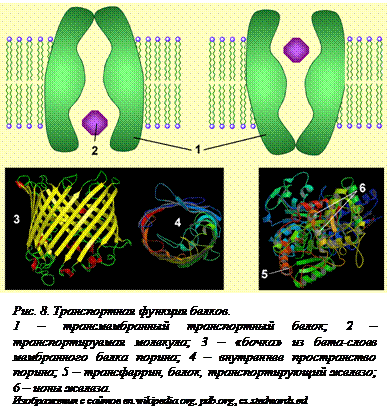 Так, белок трансферрин (рис. 8) осуществляет транспорт железа в плазме крови.
Так, белок трансферрин (рис. 8) осуществляет транспорт железа в плазме крови.
Трансформация энергии. Любой живой организм, являясь открытой системой, нуждается в поступлении энергии. Зеленые растения переводят энергию солнечного света в энергию химических связей. В ходе жизнедеятельности энергия химических связей может трансформироваться в механическую, тепловую, электромагнитную. Все эти процессы осуществляются специальными белками. Белки сетчатки глаза родопсин и ретинин трансформируют световую энергию в электрическую. Белки бактериального жгутика преобразуют энергию химических связей аденозинтрифосфорной кислоты сначала в электрическую, а потом используют ее для вращения жгутика. Особые моторные белки преобразуют энергию химических связей в механическую. Два белка – кинезин и динеин, осуществляют внутриклеточный транспорт пузырьков, заключающих в себе, например, белки, синтезированные на эндоплазматической сети и которые должны поступить в аппарат Гольджи или быть выведены из клетки. Кинезин и динеин работают по одному принципу – используя энергию АТФ, они «шагают» по микротрубочкам (рис. 9, [O9] А). Каждый из них может двигаться только в одном направлении – динеин движется от «плюс»-конца микротрубочки к «минус»-концу, а кинезин – в противоположном направлении. Они могут 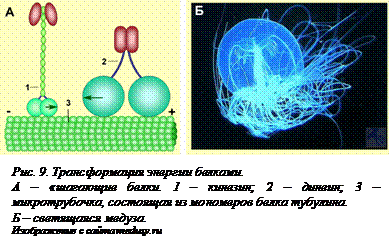 перемещать даже такие крупные по сравнению с ними органоиды, как митохондрии. Миозин, работающий по такому же принципу, осуществляет сокращение мышц.
перемещать даже такие крупные по сравнению с ними органоиды, как митохондрии. Миозин, работающий по такому же принципу, осуществляет сокращение мышц.
У некоторых рыб (электрические скаты и угри) специальные белки, встроенные в мембраны особых электрических клеток, используя АТФ, производят электрическую энергию. Накопленное в «аккумуляторах» электричество может генерировать разряд напряжением до 650 вольт! Правда, сила тока при этом не очень велика. Рыбы используют эти разряды для защиты от врагов и для оглушения своей добычи.
Некоторые морские животные и бактерии имеют специальные светящиеся белки (рис. 9, Б). Для свечения также требуется АТФ. Ученым удалось не только выделить эти белки, но и с помощью генно-инженерных методов ввести ген такого белка лабораторным животным. «Светящиеся» мыши, кролики и свиньи сейчас широко используются для исследований в области физиологии и медицины.
Питательная функция белков заключается в поставке незаменимых аминокислот. Такие аминокислоты не могут быть синтезированы в организме и должны поступать с пищей. У человека 9 из 21 аминокислоты не могут быть синтезированы в организме. Для разных животных (и грибов) незаменимыми могут быть разные аминокислоты. С питательной функцией тесно связана функция запасания аминокислот для развития зародышей и вскармливания младенцев. Аминокислоты им нужны для построения полипептидов, а запасать их выгоднее в виде белков. Например, казеин (белок молока), овальбумин (яичный белок), глиадин (белок зерен пшеницы) разлагаются клетками зародыша (или детеныша млекопитающего) до аминокислот, из которых потом строят собственные белки.
Буферная функция белков. Любой белок является амфотерным полиэлектролитом. В силу этого белки способны стабилизировать рН. В разных участках клетки протекают разные реакции, которые требуют определенных значений рН. Различные белки могут поддерживать такую разницу рН в разных частях клетки, обеспечивая этим условия для одновременного протекания разнообразных реакций.
Энергетическая функция для белков не является основной, но, тем не менее, белки могут использоваться для получения энергии. Заменимые аминокислоты, которые могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов, в клетках животных обычно дезаминируются, а потом поступают в процессы энергетического обмена. Для хищников, в рационе которых мало углеводов, энергетическая роль белков велика.
Другие функции белков. Некоторые способы использования белков трудно классифицировать. Например, некоторые животные вырабатывают белковые токсины не только для защиты, но и для нападения. Яды змей, пчел, других ядовитых животных содержат различные вещества, в том числе и ферменты, разрушающие биополимеры организма жертвы. Из змеиного яда такие ферменты получают для использования в исследовательских работах и для лечения некоторых заболеваний.
§ 4. Сложные белки и пептиды
Благодаря наличию реакционноспособных групп в радикалах аминокислот, белки, которые из них построены, обладают способностью соединяться с другими, самыми различными, молекулами. Такие сложные белки называют протеидами. В зависимости от того, с какой молекулой соединен белок, различают нуклеопротеиды, гликопротеиды, липопротеиды, хромопротеиды. Такие молекулы как ДНК, матричная РНК, рибосомные РНК вообще не могут существовать в «голом» виде, они всегда связаны с белками. В клетках они находятся в виде дезоксирибонуклеопротеидов и рибонуклеопротеидов.
Гликопротеиды – соединение белковых молекул с поли- или олигосахаридами. Многие мембранные белки-рецепторы представляют собой гликопротеиды. Белки заякоривают рецептор в мембране, а олигосахаридная часть молекулы формирует распознающий центр рецептора. Разнообразие связей между моносахаридными остатками, наличие α- и β-изомеров сахаров, существование разветвленных олигосахаридных молекул позволяет олигосахаридам формировать самые разнообразные пространственные формы. Узнавание рецептора и лиганда ведь и происходит благодаря тому, что их пространственные конфигурации подходят друг к другу как ключ к замку. Часто такие рецепторы представляют собой «опознавательные знаки» клеток, принадлежащих определенной ткани организма. Их узнавание обеспечивает сцепление клеток друг с другом при формировании органа. Гликопротеидами являются и молекулы, определяющие группу крови человека.
Особую группу гликопротеидов представляют собой протеогликаны, составляющие структурную основу соединительной ткани, хрящей, роговицы глаза (рис. 10[O10], А). В протеогликанах к фибриллярной белковой молекуле присоединено множество олигосахаридных цепей. Олигосахариды, благодаря своей высокой гидрофильности, связывают большое количество молекул воды. Это придает эластичность хрящу, гелеобразную консистенцию межклеточному веществу в тканях организма, упругость и прозрачность роговице.
Липопротеиды – сложные белки, состоящие из белковой и липидной частей. Липопротеиды входят во все мембраны клеток 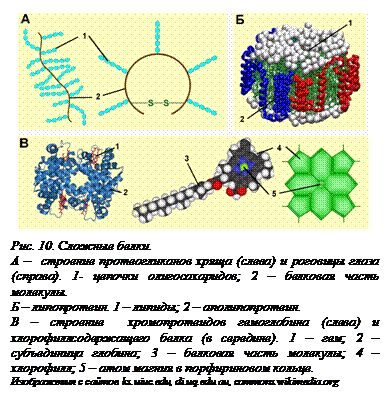 животных. Особый класс липопротеидов – молекулы, транспортирующие липиды в крови. В кровь липиды поступают из пищи или синтезируются в организме. В свободном виде липиды переноситься кровью не могут, так как в водной среде в результате гидрофобных взаимодействий они слипаются, что может привести к закупорке кровеносных сосудов и смерти. Поэтому транспортировка липидов происходит в виде липопротеидов – соединений липидов с белковыми молекулами, которые носят название аполипопротеинов (рис. 10, Б). В составе такой частицы липидная часть покрыта белковой молекулой, гидрофобные аминокислотные радикалы которой обращены к липиду, а гидрофильные – наружу. В результате гидрофобные взаимодействия между разными молекулами липидов оказываются невозможными, и частицы безопасно транспортируются кровью. Различают несколько групп таких транспортных липопротеидов, главными из которых являются липопротеиды высокой плотности и липопротеиды низкой плотности. Плотность их зависит от соотношения белок/липид. Чем больше белковая часть, тем более высокая плотность липопротеида, так как липиды – легкие молекулы, их плотность меньше плотности воды. Липопротеиды низкой плотности, в которых белка мало, при высокой концентрации их в крови могут все-таки прилипать к стенкам кровеносных сосудов, что приводит к развитию атеросклероза и повышает риск инфаркта или инсульта. С возрастом в клетках печени уменьшается количество специальных рецепторов для липопротеидов низкой плотности, которые «вылавливают» их из крови, чтобы разрушить. Поэтому и риск развития атеросклероза у человека с возрастом увеличивается.
животных. Особый класс липопротеидов – молекулы, транспортирующие липиды в крови. В кровь липиды поступают из пищи или синтезируются в организме. В свободном виде липиды переноситься кровью не могут, так как в водной среде в результате гидрофобных взаимодействий они слипаются, что может привести к закупорке кровеносных сосудов и смерти. Поэтому транспортировка липидов происходит в виде липопротеидов – соединений липидов с белковыми молекулами, которые носят название аполипопротеинов (рис. 10, Б). В составе такой частицы липидная часть покрыта белковой молекулой, гидрофобные аминокислотные радикалы которой обращены к липиду, а гидрофильные – наружу. В результате гидрофобные взаимодействия между разными молекулами липидов оказываются невозможными, и частицы безопасно транспортируются кровью. Различают несколько групп таких транспортных липопротеидов, главными из которых являются липопротеиды высокой плотности и липопротеиды низкой плотности. Плотность их зависит от соотношения белок/липид. Чем больше белковая часть, тем более высокая плотность липопротеида, так как липиды – легкие молекулы, их плотность меньше плотности воды. Липопротеиды низкой плотности, в которых белка мало, при высокой концентрации их в крови могут все-таки прилипать к стенкам кровеносных сосудов, что приводит к развитию атеросклероза и повышает риск инфаркта или инсульта. С возрастом в клетках печени уменьшается количество специальных рецепторов для липопротеидов низкой плотности, которые «вылавливают» их из крови, чтобы разрушить. Поэтому и риск развития атеросклероза у человека с возрастом увеличивается.
Хромопротеиды (рис. 10, В) – это белки, содержащие так называемые хромофорные группы (греч. cromoς – цвет и φορεο – несу). Хромофорные группы избирательно поглощают свет определенной длины волны, поэтому они придают окраску белку. В качестве хромофорной группы наиболее часто встречаются сложные гетероциклические молекулы – порфирины. Наиболее известными являются хлорофилл, содержащий атом магния, и содержащий атом железа гем. Гем входит в состав гемоглобина и цитохромов – важнейших участников процессов энергетического обмена.
Пептиды. Построенные из аминокислот полимерные молекулы, включающие в себя не более 50 мономеров, принято называть олигопептидами. Некоторые пептиды отличаются от белков только размерами. Такими «маленькими белочками» являются пептидные гормоны – инсулин, глюкагон, гормоны гипофиза и гипоталамуса. Всего в настоящее время известно несколько десятков таких гормонов. Они имеют все признаки белков – вторичную и третичную структуру, а инсулин, хотя и состоит всего из 51 аминокислоты, имеет даже четвертичную структуру. К этой группе белковоподобных пептидов относятся так называемые нейропептиды – эндорфины и энкефалины. Это пентапептиды, образующиеся в мозге млекопитающих и обладающие психотропным действием, так называемые эндогенные опиоиды. Эти вещества служат для поддержания нормального функционирования центральной нервной системы. Энкефалины повышают чувствительность к раздражителям, приводят организм в состояние «боевой готовности». Эндорфины, наоборот, понижают чувствительность к раздражителям, вызывают расслабление, ощущение счастья. Сходство пространственной формы эндорфинов с экзогенными опием и морфием, приводит к тому, что эти наркотики прочно связываются с рецепторами нейропептидов, что вызывает ощущение довольства. Но, поскольку синтез таких биологически активных веществ в организме очень строго лимитируется, занятость рецепторов приводит к тому, что нейропептиды перестают синтезироваться. После разрушения молекулы наркотика отсутствие энкефалинов и эндорфинов приводит к «ломке», когда человеку очень плохо, организму требуется наличие лигандов для рецепторов. Рецептор ведь не различает, что за лиганд с ним соединен – наркотик или нейропептид. Так возникает наркотическая зависимость, а нарушение регуляции работы центральной нервной системы очень быстро разрушает организм и приводит его к гибели. К этой же группе белковоподобных пептидов относятся нейротоксины, которые содержатся в ядах многих ядовитых животных – пчел, скорпионов, змей.
Существует большая группа природных олигопептидов, которые отличаются от белков не столько размерами, сколько строением. Некоторые пептиды могут кроме аминокислот включать и другие мономеры, например, оксикислоты. Набор аминокислот, входящих в пептиды, значительно больше, чем в белках. В пептиды могут входить так называемые небелковые α-аминокислоты, ω-аминокислоты (у которых аминогруппа присоединена к самому далекому от карбоксильной группы атому углерода), ненасыщенные аминокислоты, N-метилированные или N-гидроксилированные аминокислоты и даже правовращающие изомеры аминокислот (D-аминокислоты) (рис. 11[O11], А). В отличие от линейных молекул белков и полипептидов, молекулы олигопептидов могут быть разветвленными. Мономеры пептидов могут соединяться не только пептидными (амидными) связями, но и эфирными, и сложноэфирными, и уреидными (рис. 11, Б). Примером может служить глутатион – трипептид, состоящий из трех аминокислот (глутаминовой кислоты, цистеина и глицина), причем глутаминовая (дикарбоновая) кислота присоединена к цистеину необычной γ-пептидной связью (рис. 11, А; 12, А[O12]). Глутатион 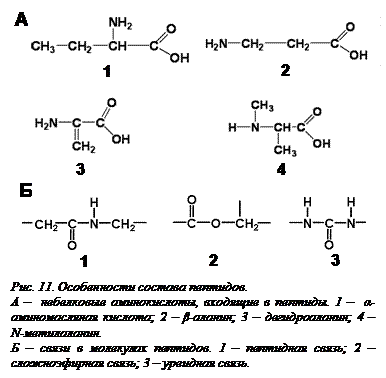 присутствует во всех живых организмах и выполняет важнейшую функцию внутриклеточного антиоксиданта, расщепляя «незаконные» дисульфидные мостики, образовавшиеся в результате окисления сульфгидрильных групп и «сшившие» молекулы белков. Он участвует также в обезвреживании свободных радикалов, пероксидов и других токсических веществ.
присутствует во всех живых организмах и выполняет важнейшую функцию внутриклеточного антиоксиданта, расщепляя «незаконные» дисульфидные мостики, образовавшиеся в результате окисления сульфгидрильных групп и «сшившие» молекулы белков. Он участвует также в обезвреживании свободных радикалов, пероксидов и других токсических веществ.
Важную группу составляют циклопептиды – пептиды, цепочка которых замкнута в кольцо. Кольцо образуется в результате взаимодействия карбоксильной и аминогруппы двух концов одной молекулы. Многие циклопептиды являются биологически активными веществами – антибиотиками, токсинами, переносчиками ионов. Как правило, именно эти пептиды содержат D-аминокислоты и оксикислоты и бывают разветвленными. Например, молекула антибиотика грамицидина S представляет собой кольцо, составленное из двух идентичных половин и содержащее небелковую аминокислоту орнитин и D-фенилаланин (рис. 12, В). Смертельно опасный яд бледной поганки a-аманитин – 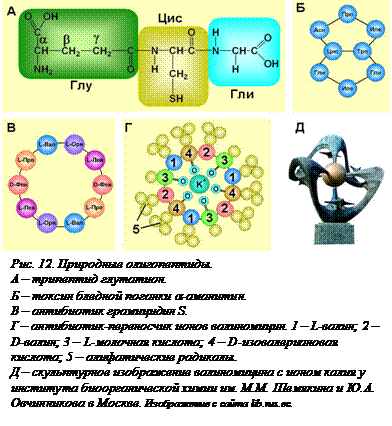 циклопептид, состоящий из восьми аминокислот. Его молекула замкнута в кольцо и, кроме того, содержит мостик, образовавшийся в результате ветвления молекулы (рис. 12, Б). Молекулы пептидов могут ветвиться в тех местах, где находятся аминокислоты, имеющие и другие функциональные группы, кроме карбоксильной и α-аминогруппы. Это дикарбоновые аминокислоты (аспарагиновая и глутаминовая), диаминокислоты (аргинин, лизин), аминокислоты, содержащие спиртовые группы (серин, треонин, тирозин), иминогруппы (триптофан). Например, a-аманитин представляет собой разветвленный циклопептид, состоящий из восьми аминокислот. За счет того, что входящие в его состав цистеин и триптофан образуют между собой связь (кроме обычных пептидных связей), этот пептид представляет собой не одно, а два кольца. Антибактериальное действие антибиотика валиномицина обусловлено его способностью переносить ионы калия, снижая концентрацию калия в клетке и нарушая тем самым жизнедеятельность бактерии. Эта его способность обусловлена особенностями строения молекулы (рис. 12, Г). В ее состав, кроме обычной аминокислоты L-валина, входят D-валин, L-молочная кислота (оксикислота) и D-изовалериановая (карбоновая) кислота. В гидрофобной среде (например, в плазмалемме) молочная и изовалериановая кислоты обращены своими атомами кислорода внутрь кольца, а алифатические части молекул валина и изовалериановой кислоты образуют подобие гидрофобной оболочки. В результате молекула может встроиться в мембрану. Внутри кольца образуется канал с гидрофильными стенками, с которыми могут связываться ионы, в первую очередь К+, наиболее подходящий по размеру. Такие переносчики ионов (ионофоры) широко используются в биохимических и биофизических исследованиях.
циклопептид, состоящий из восьми аминокислот. Его молекула замкнута в кольцо и, кроме того, содержит мостик, образовавшийся в результате ветвления молекулы (рис. 12, Б). Молекулы пептидов могут ветвиться в тех местах, где находятся аминокислоты, имеющие и другие функциональные группы, кроме карбоксильной и α-аминогруппы. Это дикарбоновые аминокислоты (аспарагиновая и глутаминовая), диаминокислоты (аргинин, лизин), аминокислоты, содержащие спиртовые группы (серин, треонин, тирозин), иминогруппы (триптофан). Например, a-аманитин представляет собой разветвленный циклопептид, состоящий из восьми аминокислот. За счет того, что входящие в его состав цистеин и триптофан образуют между собой связь (кроме обычных пептидных связей), этот пептид представляет собой не одно, а два кольца. Антибактериальное действие антибиотика валиномицина обусловлено его способностью переносить ионы калия, снижая концентрацию калия в клетке и нарушая тем самым жизнедеятельность бактерии. Эта его способность обусловлена особенностями строения молекулы (рис. 12, Г). В ее состав, кроме обычной аминокислоты L-валина, входят D-валин, L-молочная кислота (оксикислота) и D-изовалериановая (карбоновая) кислота. В гидрофобной среде (например, в плазмалемме) молочная и изовалериановая кислоты обращены своими атомами кислорода внутрь кольца, а алифатические части молекул валина и изовалериановой кислоты образуют подобие гидрофобной оболочки. В результате молекула может встроиться в мембрану. Внутри кольца образуется канал с гидрофильными стенками, с которыми могут связываться ионы, в первую очередь К+, наиболее подходящий по размеру. Такие переносчики ионов (ионофоры) широко используются в биохимических и биофизических исследованиях.
Таким образом, функции природных олигопептидов необычайно разнообразны. Из-за своих небольших размеров олигопептиды не могут выполнять свойственную белкам структурную функцию. Как правило, олигопептиды не могут быть и ферментами. Это связано с тем, что в силу своих небольших размеров они неспособны к образованию стабильной вторичной и третичной структуры, их конформация может быть очень изменчивой. Поэтому они не могут образовывать настоящий активный центр, имеющий строго определенную пространственную форму. Отсутствие третичной структуры делает пептиды неспособными к денатурации. Зато регуляторная функция выполняется пептидами очень эффективно. Это и гормоны, и нейропептиды, и так называемые рилизинг-факторы (высвобождающие из клетки запасенные вещества), регуляторы свертывания крови, иммуномодуляторы, регуляторы сна, аппетита, различных форм поведения. Защитная функция пептидов – это многочисленные токсины животных и грибов, а также антибиотики. Выделены также пептиды, придающие определенный вкус жареному мясу, соевому соусу и другим блюдам. Искусственно синтезированный дипептид аспартам оказался в 200 раз слаще сахара. Он сейчас используется как безопасный заменитель сахара для больных диабетом. Ученые считают, что природные олигопептиды участвуют практически во всех физиологических процессах, осуществляя «тонкую настройку» регуляции. Неслучайно у главного входа в Институт биоорганической химии в Москве стоит «памятник антибиотику» – скульптура валиномицина, связанного с ионом калия (рис. 12, Д).
§ 5. Строение и функции нуклеиновых кислот.
Для функционирования клеток и организмов необходимы не только «материалы и инструменты» (белки), но и «инструкции по изготовлению и использованию», и «чертежи», то есть, информация о строении белков. Белки, как уже говорилось, не способны к хранению и передаче информации. «Информационными молекулами» являются нуклеиновые кислоты – дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Они представляют собой линейные нерегулярные полимеры, мономерами которых являются нуклеотиды.
Нуклеотидами называют сложные молекулы, состоящие из трех более простых молекул – пятиуглеродного сахара (рибозы или дезоксирибозы), азотистого основания (гетероциклического азотсодержащего соединения) и остатка фосфорной кислоты. Азотистые основания являются производными пурина и пиримидина (рис. 13[O13], А)). Так как и сахара, и азотистые основания могут существовать и отдельно друг от друга, и для каждого из них 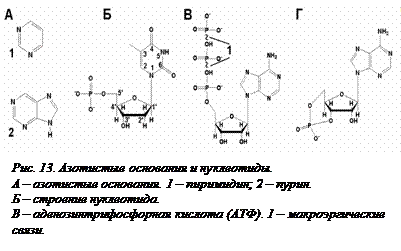 есть общепринятая нумерация атомов в молекуле, то в составе нуклеотида атомы сахара обозначаются цифрами со штрихом. В нуклеотиде азотистое основание всегда присоединено к сахару в положении 1-1’, а остаток фосфорной кислоты находится в 5’-положении (рис. 13, Б). Азотистых оснований существует довольно много, так как у разных атомов гетероциклов могут быть разные заместители, но в состав нуклеиновых кислот в основном входят только пять из них – аденин, гуанин, тимин и цитозин в состав ДНК и аденин, гуанин, урацил и цитозин в состав РНК. Сокращенно их принято обозначать начальными буквами – А, Г, Т, Ц, У. В некоторых случаях в состав нуклеиновых кислот могут входить так называемые минорные (неглавные) основания, отличающиеся наличием или отсутствием определенных групп. Больше всего минорных оснований находится в транспортных РНК.
есть общепринятая нумерация атомов в молекуле, то в составе нуклеотида атомы сахара обозначаются цифрами со штрихом. В нуклеотиде азотистое основание всегда присоединено к сахару в положении 1-1’, а остаток фосфорной кислоты находится в 5’-положении (рис. 13, Б). Азотистых оснований существует довольно много, так как у разных атомов гетероциклов могут быть разные заместители, но в состав нуклеиновых кислот в основном входят только пять из них – аденин, гуанин, тимин и цитозин в состав ДНК и аденин, гуанин, урацил и цитозин в состав РНК. Сокращенно их принято обозначать начальными буквами – А, Г, Т, Ц, У. В некоторых случаях в состав нуклеиновых кислот могут входить так называемые минорные (неглавные) основания, отличающиеся наличием или отсутствием определенных групп. Больше всего минорных оснований находится в транспортных РНК.
Аденозинфосфаты. Из всех нуклеотидов особое положение занимает адениловый рибонуклеотид. Его функции в клетке чрезвычайно разнообразны. Кроме того, что он является мономером РНК, он в форме трифосфата представляет собой универсальную энергетическую валюту всех клеток – АТФ. Три остатка фосфорной кислоты присоединены к рибозе в виде цепочки. Две связи между последними остатками, называемые макроэргическими, для своего образования требуют много энергии, которая и выделяется при их расщеплении и используется клеткой в сопряженных химических реакциях. Их принято обозначать знаком ~ (рис. 13, В). В некоторых случаях в роли носителя энергии может выступать ГТФ – гуанозинтрифосфат.
Аденозинмонофосфат также является очень важным соединением. Остаток фосфорной кислоты в его составе может вступать в еще одну связь с остатком рибозы – в положении 3’, образуя так называемый циклический аденозинмонофосфат (цАМФ) (рис. 13, Г). Эта молекула является одним из основных внутриклеточных переносчиков сигналов (см. подробнее § 30).
Производными аденозинфосфатов являются некоторые коферменты. Например, важнейшими коферментами, участвующими в окислительно-восстановительных реакциях в клетке являются динуклеотиды, обозначаемые аббревиатурами НАД, НАДФ, ФАД. В них одним нуклеотидом обязательно является аденозинфосфат. В качестве азотистого основания второго нуклеотида выступают витамины группы В – никотинамид, флавин.
Первичная структура нуклеиновых кислот. Нуклеиновые кислоты – очень длинные молекулы. Их цепочки могут насчитывать десятки миллионов мономеров. При этом все мономеры соединены друг с другом только одним способом – 3’-гидроксильная группа одного нуклеотида соединена эфирной связью с остатком фосфорной кислоты, находящейся в 5’-положении соседнего нуклеотида. Такое соединение можно рассматривать как диэфир фосфорной кислоты, поэтому оно и называется 3’-5’-фосфодиэфирной связью (рис. 14[O14]). В 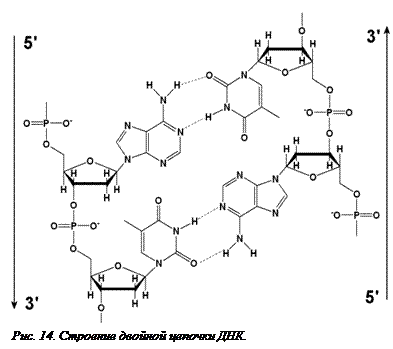 результате нуклеиновая кислота всегда на 3’-конце имеет гидроксильную группу, а на 5’-конце – остаток фосфорной кислоты. ДНК бактерий, некоторых вирусов, а также клеточных органоидов (митохондрий и хлоропластов) концов не имеет, так как они ковалентно замкнуты и представляют собой кольцо.
результате нуклеиновая кислота всегда на 3’-конце имеет гидроксильную группу, а на 5’-конце – остаток фосфорной кислоты. ДНК бактерий, некоторых вирусов, а также клеточных органоидов (митохондрий и хлоропластов) концов не имеет, так как они ковалентно замкнуты и представляют собой кольцо.
Азотистые основания в соединении нуклеотидов одной цепи участия не принимают. Поэтому основу молекулы составляет так называемый сахаро-фосфатный скелет, имеющий регулярную структуру. Нерегулярность всей молекуле придает чередование азотистых оснований.
Вторичная структура ДНК. Молекула ДНК имеет уникальную вторичную структуру, не свойственную никакой другой природной молекуле. Она состоит их двух цепочек, которые закручены друг вокруг друга, образуя правозакрученную спираль. При этом сахаро-фосфатный скелет находится снаружи молекулы, а азотистые основания противоположных цепочек обращены друг к другу и соединяются водородными связями (рис. 14). Из четырех азотистых оснований, входящих в состав ДНК, водородные связи могут образовывать только пары А-Т (две водородные связи) и Г-Ц (три водородные связи). Поэтому последовательность нуклеотидов в одной из цепочек ДНК однозначно определяет последовательность нуклеотидов во второй цепочке. Такие пары нуклеотидов называются комплементарными (взаимодополнительными). Строение и пространственная организация нуклеотидов такова, что водородные связи могу образоваться только в том случае, когда цепочки одной молекулы расположены антипараллельно – против 3’-конца одной цепочки всегда находится 5’-конец другой. Таким образом, принципами строения ДНК являются: 1) двуцепочечность; 2) комплементарность; 3) антипараллельность; 4) нерегулярность.






