Все химические реакции можно условно разбить на две группы: необратимые и обратимые. Необратимые реакции протекают до конца, до полного расходования одного из реагирующих веществ, так как реакция протекает только в одном направлении:
MgCO3 ® MgO + CO2
Обратимые реакции протекают одновременно в двух противоположных направлениях, следовательно, протекают не до конца. Большинство химических реакций являются обратимыми. В общем случае для реакции
nA+ mB«pC+qD
применим закон действующих масс. Скорость прямой реакции равна

а скорость обратной реакции –

С течением времени скорость прямой реакции уменьшается, а обратно – увеличивается. Состояние системы, в котором скорости прямой и обратной реакций равны, называют химическим равновесием. В состоянии равновесия скорости прямой и обратной реакции постоянны (не меняются во времени), а значит постоянны и концентрации реагирующих веществ. Концентрации реагирующих веществ в состоянии равновесия называют равновесными концентрациями.
Для состояния равновесия можно записать

Откуда можно выразить отношение константы скорости прямой и обратной реакций через равновесные концентрации реагирующих веществ:

Это выражение называется константой равновесия Кс – отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ в степенях, соответствующих стехиометрическим коэффициентам в уравнении реакции. Для установившегося равновесия при данной температуре это величина постоянная. Константа равновесия определяет глубину протекания процесса к моменту наступления равновесия. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Константа равновесия так же, как и константа скорости, зависит от природы реагирующих веществ и от температуры и не зависит от концентраций реагирующих веществ. Константу равновесия, выраженную через молярные концентрации реагирующих веществ, обозначают KC, а через парциальные давления реагирующих газообразных веществ – KP. Например, для гомогенной реакции
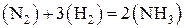
выражение константы равновесия имеет такой вид

 ,
,  .
.
В случае гетерогенных реакций в выражение KC входят концентрации веществ в газовой и жидкой фазе, а в выражение KP - только парциальные давления газообразных веществ. Для гетерогенной реакции

выражение константы равновесия запишется в таком виде
 ,
,  .
.
Состояние равновесия сохраняется до тех пор, пока на систему не оказано внешнее воздействие: изменение температуры, концентрации реагирующих веществ или давления. При этом нарушается равенство скоростей прямой и обратной реакций, но через некоторое время скорости снова выравниваются. Однако новое состояние равновесия смещено относительно старого в направлении той реакции, которая временно протекала с большей скоростью. В новом состоянии равновесия равновесные концентрации будут другими. Такой переход от одного равновесного состояния к другому называется смещением равновесия. Направление смещения равновесия можно определить руководствуясь принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Внешнее воздействие на систему и на положение химического равновесия оказывают следующие факторы:
– давление (повышение давления смещает равновесие в сторону реакции, идущей с уменьшением числа молекул газа);
– температура (увеличение температуры смещает равновесие в сторону эндотермической реакции);
– концентрация (возрастание концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, по которой это вещество расходуется).
Пример 1. Какими изменениями температуры, давления и концентрации H2 можно повысить выход продуктов в системах:
a) (N2) + 3(H2) «2(NH3) DH0= -92 кДж;
б) [C] + (H2O) «(CO) +(H2) –Q;
Решение. Чтобы повысить выход продуктов, нужно так изменить температуру, давление и концентрацию H2, чтобы химическое равновесие сместилось в сторону прямой реакции, т. е. вправо.
a) (N2) + 3(H2) «2(NH3) DH0= -92 кДж;
Согласно принципу Ле Шателье, повышение температуры смещает равновесие в сторону эндотермической реакции. Так как прямая реакция экзотермическая (DH° < 0), то обратная реакция – эндотермическая, и повышение температуры сместит равновесие влево. Следовательно, для смещения равновесия вправо температуру нужно уменьшить.
Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением числа молекул газа. В левой части уравнения реакции 4 молекулы газа, в правой – 2, значит, прямая реакция идет с уменьшением числа молекул газа и для смещения равновесия вправо, давление нужно увеличить.
Повышение концентрации реагирующих веществ смещает равновесие в сторону реакции, по которой это вещество расходуется. H2 – исходное вещество и расходуется при протекании прямой реакции, следовательно, для смещения равновесия вправо концентрацию H 2 нужно увеличить.
б) [C] + (H2O) «(CO) +(H2) –Q;
Так как прямая реакция эндотермическая (Q <0), то для смещения равновесия вправо температуру нужно увеличить.
В левой части уравнения 1 молекула газа, в правой – 2. Следовательно прямая реакция идет с увеличением числа молекул газа и для смещения равновесия вправо давление нужно уменьшить.
H2 – продукт реакции и расходуется при протекании обратной реакции. Поэтому для смещения равновесия вправо концентрацию H2 нужно уменьшить.
Ответ: а) T ¯ (уменьшить), P (увеличить), C (H2) (увеличить);
б) T (увеличить), P ¯ (уменьшить), C (H2) ¯ (уменьшить).
Ниже приведены примеры вычисления равновесных концентраций веществ, констант равновесия и исходных (начальных) концентраций веществ, т. е. концентраций в момент смешивания исходных веществ, когда продукты реакции отсутствуют. Равновесные концентрации веществ обозначим символом С, исходные концентрации – С 0, а изменения концентраций исходных веществ и продуктов реакции к моменту наступления равновесия – D С. При решении задач предполагаем, что объем системы постоянен и, значит, количества веществ пропорциональны их молярным концентрациям (С). Поэтому для упрощения рассуждений принимается, что объем системы равен 1 л, тогда количества веществ равны концентрациям. Равновесные концентрации продуктов реакции и D С веществ будут пропорциональны стехиометрическим коэффициентам соответствующих веществ в уравнении реакции. C, C 0 и D С исходных веществ реакции связаны соотношением
С 0 = С + D С, адля продуктов реакции С = D С.
Пример 2. Найдите равновесные концентрации CH4, H2O и H2 в системе
(CH4) + (H2O) «(CO) + 3 (H2)
если известно, что начальные концентрации CH4 и H2O равны 0,1 и 0,2 моль/л соответственно, а равновесная концентрация CO составляет 0,08 моль/л. Определите константу равновесия KC.
| Дано: C 0(CH4) = 0,1 моль/л C 0(H2O) = 0,2 моль/л C (CO) = 0,08 моль/л | Решение. По условию задачи к моменту наступления равновесия образовалось 0,08 моль CO. Составляем пропорцию согласно коэффициентам в уравнении реакции: |
| KC –? |
при образовании 1 моль CO образуется 3 моль Н2
при образовании 0,08 моль CO —//— x моль Н2
 моль, С (H2) = 0,24 моль/л.
моль, С (H2) = 0,24 моль/л.
Аналогично находим D С для СН4 и H2O:
на образование 1 моль CO расходуется 1 моль СН4
на образование 0,08 моль CO —//— x моль СН4
 моль, D С (CH4) = 0,08 моль/л;
моль, D С (CH4) = 0,08 моль/л;
на образование 1 моль CO расходуется 1 моль Н2O
на образование 0,08 моль CO —//— x моль Н2O
 моль, D С (H2O) = 0,08 моль/л.
моль, D С (H2O) = 0,08 моль/л.
Тогда равновесные концентрации исходных веществ (С = С 0 – D С) составляют:
C (CH4) = 0,1 – 0,08 = 0,02 моль/л,
C (H2O) = 0,2 – 0,08 = 0,12 моль/л.
Если коэффициенты в уравнении реакции невелики, то вычисления С и D С часто проводят в уме и представляют их в форме таблицы:
| (CH4) + (H2O) D (CO) + 3(H2) | |||||
| Co С 0 | 0,1 | 0,2 | – | – | |
| D С | 0,08 | 0,08 | 0,08 | 0,24 | |
| С | 0,02 | 0,12 | 0,08 | 0,24 | |
Константа равновесия рассматриваемой реакции будет равна
 .
.
Пример 3. При некоторой температуре константа равновесия реакции
| [C] + (CO2) D 2(CO) |
равна 0,1. Найдите равновесные концентрации CO2 и CO в системе, если исходная концентрация CO2 равна 0,01 моль/л.
Решение. Поскольку коэффициенты реакции невелики представляем вычисление значений С и D С в табличной форме. Принимаем, что к моменту наступления равновесия прореагировало x моль CO2, т.е. D С (CO2) = x моль/л.
| [C] + (CO2) D 2(CO) | |||
| С 0 | – | 0,01 | – |
| D С | – | X | 2 x |
| С | – | 0,01 - x | 2 x |
Так как содержание твердых веществ в системе не оказывает влияния на химическое равновесие и концентрации веществ в твердом состоянии не входят в выражение константы равновесия, то для углерода [C] в таблице не приведено значений. Записываем выражение константы равновесия для рассматриваемой реакции:
 .
.
Из этого выражения находим x:
 ;
;
4 x 2 + 0,1 x – 0,001 = 0;
D = 0,01 + 4 × 4 × 0,001 = 0,026;
 (не подходит),
(не подходит),
 (подходит).
(подходит).
Следовательно равновесные концентрации веществ будут равны:
C (CO2) = 0,01 - 0,00766 = 0,00234 моль/л;
C (CO) = 2 × 0,00766 = 0,01532 моль/л.
Пример 4. Исходные концентрации N2 и O2 в системе
(N2) + (O2) D 2(NO)
равны 0,03 и 0,01 моль/л соответственно. К моменту наступления равновесия в реакцию вступило 5% N2. Определите равновесные концентрации веществ в системе и константу равновесия.
Решение. Вычисляем количество N2 вступившего в реакцию:
0,03 моль N2 – 100%
x моль N2 – 5%
 моль, D С (N2) = 0,0015 моль/л.
моль, D С (N2) = 0,0015 моль/л.
Представляем значения С и D С в табличном виде:
| (N2) + (O2) D 2(NO) | |||
| С 0 | 0,03 | 0,01 | – |
| D С | 0,0015 | 0,0015 | 2×0,0015 |
| С | 0,03-0,0015 | 0,01-0,0015 | 2×0,0015 |
Равновесные концентрации веществ будут равны:
C (N2) = 0,0285 моль/л; C (O2) = 0,0085 моль/л; C (NO) = 0,003 моль/л.
Константа равновесия данной реакции составит:
 .
.






