Существует два типа превращений:
1) Фазовые – превращения вещества, при которых изменяется структура или его агрегатное состояние, но не меняется количественный состав.
Например: плавление [H2O] ® {H2O}
испарение {H2O} ® (H2O)
сублимация [I2] ® (I2)
2) Химические – превращения, при которых изменяются химический состав и структура вещества
Например: MgCO3 ® MgO + CO2
Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом является электронейтральной.
Для определения степени окисления элемента следует учитывать следующие положения.
1. Степени окисления атомов в простых веществах равны нулю ( ).
).
2. Постоянную степень окисления имеют атомы металлов IA группы (+1), атомы металлов IIA группы (+2), алюминия (+3), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода –1), кислорода (–2) (за исключением  и пероксидов, в которых степень окисления кислорода –1), фтора (–1).
и пероксидов, в которых степень окисления кислорода –1), фтора (–1).
3. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Степень окисления одного из элементов в соединении вычисляется через известные степени окисления других элементов. Например:

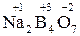
 .
.
2∙ x + 5∙(–2) = 0; 2∙1 + 4∙ x + 7∙(–2) = 0; 2∙1 + 1 + x + 4∙(–2) = 0
x = +5 x = +3 x = +5
Классификацию химических реакций можно проводить по разным признакам. По числу и составу исходных веществ и продуктов реакции различают:
– реакции присоединения SO2 + Na2O ® Na2SO3
– реакции разложения Cu(OH)2 ® CuO + H2O
– реакции обмена AgNO3 + KCl ® AgCl + KNO3
– реакции замещения 2AgNO3 + Cu ® 2Ag + Cu(NO3)2
Также все реакции можно разделить на два типа: реакции без изменения степени окисления и реакции с изменением степени окисления.
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окислительно-восстановительными (ОВР):


Восстановителями называют вещества (атомы, ионы), отдающие электроны. Степень окисления атома-восстановителя повышается:
Mg0 – 2e– ® Mg+2
2Cl–1 – 2e– ® Cl2
Окислителями называют вещества (атомы, ионы), принимающие электроны. Степень окисления атома-окислителя понижается:
Mn+4 + 2e– ® Mn+2
O2 + 4e– ® 2O–2
где O2 и MnO2 – окислители, восстанавливаются; Mg и HCl – восстановители, окисляются.
При протекании ОВР атомы в высшей степени окисления являются только окислителями, в низшей – только восстановителями. Атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями, т. е. проявляют окислительно-восстановительную двойственность. Например:
H2SO4 – проявляет только окислительные свойства, является окислителем (степень окисления серы +6 – высшая);
H2SO3 – проявляет окислительно-восстановительную двойственность, является и окислителем, и восстановителем (степень окисления серы +4 – промежуточная);
H2S – проявляет только восстановительные свойства, является восстановителем (степень окисления серы –2 – низшая).
На протекание ОВР могут оказывать воздействие следующие факторы:
– концентрация окислителя;
– природа окислителя и восстановителя;
– температура;
– характер среды (кислая, нейтральная или щелочная).
В периодах периодической системы слева направо увеличивается окислительная способность атомов элементов, уменьшается их восстановительная способность. В главных подгруппах сверху вниз усиливается восстановительная способность атомов элементов и уменьшается их окислительная способность.
Наиболее активными восстановителями являются металлы I и II групп, H2, CO, H2S, SO2, H2SO3, сульфиты; KI, KBr, KI; NH3, NO, cоли: SnCl2, FeSO4, MnSO4, Cr2(SO4)3.
Наиболее активными окислителями – неметаллы VI и VII групп (кислород, озон, галогены); соли (KMnO4, K2MnO4, K2Cr2O7, K2CrO4, FeCl3; гипохлориты, хлораты, перхлораты); кислоты-окислители: HNO3, H2SO4(конц.), «царская водка»; оксиды металлов: PbO2, MnO2, CrO3, Ag2O, CuO;
Типы окислительно-восстановительных реакций:
1. Межмолекулярного окисления восстановления. Это реакции, в которых изменение степени окисления атомов происходит в молекулах разных веществ.
2KMn+7O4 + 10KI-1 + 8H2SO4 = =2Mn+2SO4 +5I  +6K2SO4+8H2O
+6K2SO4+8H2O
Fe  O3 + 3H
O3 + 3H  = 2Fe0 + 3H2O
= 2Fe0 + 3H2O
2. Внутримолекулярного окисления восстановления. Это реакции, в которых изменение степени окисления атомов происходит в одной молекуле
2KCl+5O 
 2KCl–1 + O
2KCl–1 + O 
2NaN+5O 
 2NaN+3O2+ O
2NaN+3O2+ O 
3. Диспропорционирования (самоокисления, самовосстановления). Это реакции, в которых происходит изменение степени окисления одинаковых атомов в молекуле одного и того же вещества
Cl  +2NaOH=NaCl-1+NaCl+1O+ + H2O
+2NaOH=NaCl-1+NaCl+1O+ + H2O
3K2Mn+6O4+2H2O=2KMn+7O4+ +Mn+4O2+4KOH
2N+4O2+2KOH=KN+5O3+KN+3O2++H2O
Окислительные свойства серной кислоты. В зависимости от концентрации серная кислота ведет себя различным образом. В разбавленных растворах окислительные свойства серной кислоты проявляются только по отношению к металлам, находящимся в электрохимическом ряду напряжений металлов до водорода. При этом выделяется водород и образуется соль.
В концентрированных растворах серной кислоты окислительные свойства проявляет сера в степени окисления +6. Продукты восстановления серной кислоты определяются активностью взаимодействующих с ней металлов, согласно ряду напряжений:
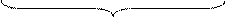 Li K Ba Sr Ca Na Mg Al Mn Zn Li K Ba Sr Ca Na Mg Al Mn Zn
| Cr Fe Cd Co Ni Sn Pb | H | Sb Bi Cu Ag Hg | Pt Au |

| 
| 
| ||
| I | II | III | IV | |
| активные | средней активности | неактивные |
Схемы процессов взаимодействия серной кислоты с металлами можно представить следующим образом:

Fe+ H2SO4(разб.) = FeSO4 + Н2

4Mg + H2SO4(конц.) = 4MgSO4 + H2S + 4H2O;
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O;
Исключением из приведенной схемы являются Al, Cr, Fe, которые не реагируют без нагревания с H2SO4(конц) ввиду пассивации.
Некоторые неметаллы взаимодействуют с концентрированной серной кислотой, при этом они восстанавливают ее до SO2:

P окисляется до H3PO4; As – до H3AsO4; C – до H2CO3 (H2O + CO2).
C + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O.
Окислительные свойства азотной кислоты. Окислителем в молекуле азотной кислоты является ион NO3– (N+5), который в зависимости от концентрации HNO3 и активности восстановителя (например, металла) принимает от 1 до 8 электронов, образуя:




 (NH4NO3)
(NH4NO3)

 уменьшение концентрации кислоты
уменьшение концентрации кислоты
снижение активности восстановителя
Схемы процессов взаимодействия азотной кислоты с металлами можно представить следующим образом:


Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2O;
4Ca + 2HNO3(конц.) = 4Ca(NO3)2 + N2O + 5H2O;
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Так же, как и для концентрированной серной кислоты, Al, Cr, Fe не реагируют без нагревания с HNO3(конц) ввиду пассивации.
Неметаллы восстанавливают концентрированную азотную кислоту до NO2 или NO, при этом сами окисляются, как правило, до своей кислоты в высшей степени окисления:

Окислительные свойства перманганата калия. При взаимодействии KMnO4 с восстановителем образуются различные продукты восстановления в зависимости от кислотности среды в соответствии со следующей схемой:

2KMnO4 + 5Zn + 8H2SO4 = 2MnSO4 + 5ZnSO4 + K2SO4 + 8Н2О
2KMnO4 + 3Na2SO3 + Н2О = 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 3Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + Н2О.
Окислительные свойства дихромата и хромата калия. При восстановлении K2Cr2O7 и K2CrO4 cтепень окисления хрома понижается с +6 до +3 в соответствии с представленными ниже схемами:

K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7Н2О






