Температура кипения - это температура, при которой давление насыщенного пара жидкости равно атмосферному давлению. Вода кипит при 100оС, если давление ее насыщенного пара равно 1 атм.
Температура замерзания - это температура, при которой давление насыщенного пара над жидкостью становится равным давлению пара над соответствующим веществом, находящимся в твердой фазе.
Пусть раствор нелетучего вещества закипает при некоторой температуре, при этом в результате частичного улета летучего растворителя концентрация раствора увеличивается, количество растворителя (N1) уменьшается, давление над раствором понижается (уравнение 2). Процесс - равновесный, поэтому для восстановления равновесия нужно повысить температуру, чтобы вновь достичь равенства давления насыщенного пара над раствором и атмосферного (кипения).
Следовательно: раствор кипит при более высокой температуре, чем чистый растворитель.
Понижение давления пара при введении растворенного вещества в чистый растворитель приводит к тому, что раствор замерзает при более низкой температуре, чем чистый растворитель.
Рассмотрим диаграмму, отражающую взаимосвязь между температурой и давлением при равновесии различных фаз.
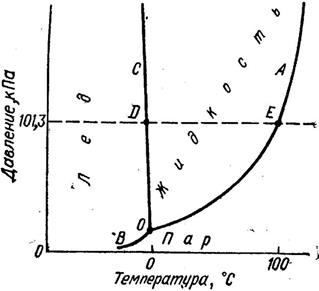
На диаграмме: линия ОА соответствует равновесию жидкость - пар; линия BO - равновесию твердое - пар; линия ОВ выражает взаимосвязь между температурой и давлением при плавлении. В точке О находятся в равновесии твердая, жидкая и парообразная фаза; 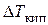 - повышение температуры кипения.
- повышение температуры кипения.  - понижение температуры замерзания раствора по сравнению с чистым растворителем.
- понижение температуры замерзания раствора по сравнению с чистым растворителем.  - понижение давления насыщенного пара над раствором по сравнению с чистым растворителем.
- понижение давления насыщенного пара над раствором по сравнению с чистым растворителем.
Эбуллиоскопический закон Рауля: DТкип – повышение температуры кипения раствора по сравнению с температурой кипения растворителя пропорционально моляльной концентрации растворенного вещества.
Δ Tкип, = Кэб · в(х)
где 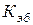 – эбуллиоскопическая постоянная, коэффициент пропорциональности.
– эбуллиоскопическая постоянная, коэффициент пропорциональности.
 - повышение температуры кипения,
- повышение температуры кипения,
в(х) - моляльная концентрация растворенного вещества.
Криоскопический закон Рауля: DТзам – понижение температуры замерзания раствора по сравнению с температурой замерзания растворителя пропорционально моляльной концентрации растворенного вещества.
Δ Tзам, = Ккр · в(х)
где 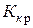 – криоскопическая постоянная.
– криоскопическая постоянная.
Физический смысл эбуллиоскопической и криоскопической постоянных определяется следующим образом.
Их числовые значения показывают, на сколько градусов выше кипел бы или на сколько градусов ниже замерзал бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя, по сравнению с температурами кипения и замерзания чистого растворителя.
Эбуллиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для некоторых растворителей имеются в таблицах. Значения 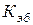 и
и 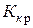 для воды равны 0,516 град×моль–1×кг и 1,86 град×моль–1×кг соответственно.
для воды равны 0,516 град×моль–1×кг и 1,86 град×моль–1×кг соответственно.
Для определения молярной массы растворенного вещества, если известно повышение температуры кипения или понижение температуры замерзания раствора, удобно пользоваться следующим соотношением:
 ,
,
где 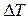 - повышение температуры кипения или понижение температуры замерзания раствора по сравнению с соответствующими характеристиками чистого растворителя;
- повышение температуры кипения или понижение температуры замерзания раствора по сравнению с соответствующими характеристиками чистого растворителя;
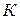 - эбуллиоскопическая или криоскопическая константа (единицы измерения град×моль–1×кг); отношение
- эбуллиоскопическая или криоскопическая константа (единицы измерения град×моль–1×кг); отношение 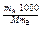 представляет собой выражение моляльной концентрации, где mB – масса растворителя;
представляет собой выражение моляльной концентрации, где mB – масса растворителя; 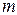 A - масса растворенного вещества; М - молярная масса растворенного вещества.
A - масса растворенного вещества; М - молярная масса растворенного вещества.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Теория электролитической диссоциации
Экспериментально установлено, что законы Рауля и принцип Вант-Гоффа не выполняются для растворов электролитов (даже бесконечно разбавленных). Вещества, распадающиеся в растворах или расплавах на положительно и отрицательно заряженные ионы, называются электролитами. Кислоты, основания и соли являются электролитами. Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией.
Изучая свойства растворов, шведский ученый С. Аррениус пришел к заключению, что понижение температуры затвердевания и повышение температуры кипения водных растворов солей, кислот и оснований и их электропроводность объясняются диссоциацией молекул электролитов на положительно и отрицательные ионы. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Эти ионы, находящиеся в непрерывном движении, и обуславливают электропроводность растворов.
Так как при электролитической диссоциации из одной молекулы образуется два и более ионов, то общее число частиц в растворе увеличивается, поэтому понижение температуры затвердевания и повышение температуры кипения раствора электролита оказываются большими, чем у растворов неэлектролитов такой же концентрации.
В растворах электролитов происходит сольватация (или гидратация) отдельных ионов. Процесс сольватации сопровождается взаимодействием ионов растворенного вещества с молекулами растворителя. Возрастание числа сольватирующихся частиц (молекул или ионов), значительно увеличивает число молекул растворителя, участвующих в процессе сольватации.
Для применения законов Рауля к растворам электролитов, в уравнения, выражающие зависимость свойств раствора от его концентрации, вводится поправочный множитель, который называется изотоническим коэффициентом Вант-Гоффа и обозначается i.
D Tз = i . Kкр . Сm,
D Tкип = i . Kэб . Сm,
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
Электролитическую диссоциацию можно рассматривать как химическую реакцию и выражать уравнением реакции. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие.
Диссоциация кислот в водных растворах происходит с образованием катиона водорода.
Упрощенные схемы диссоциации сильных и слабых кислот:
| Сильные | Слабые | |
HNO3 = H+ + NO 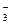
| H2CO3 ⇄ H+ + HСO3- | |
H2SO4 = 2H+ + SO 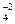
| HСO3-⇄ H+ + СO32- | |
| Для многоосновных слабых кислот записываются отдельные ступени диссоциации. | ||
Диссоциация оснований в водных растворах происходит с образованием анионов только одного вида – гидроксид-ионов.
Упрощенные схемы электролитической диссоциации сильных и слабых оснований:
| Сильные | Слабые | |
| KOH = K+ + OH– | Cu(OH)2 ⇄ CuOH+ + OH– | |
| Sr(OH)2 = Sr2+ + 2OH– | CuOH+ ⇄ Сu2+ + OH– | |
| Для многокислотных слабых оснований записываются отдельные ступени диссоциации. | ||
Диссоциация средних солей происходит с образованием катиона металла и аниона кислотного остатка. Упрощенная модель диссоциации средних солей предполагает диссоциацию их в одну стадию и может быть представлена схемами:
KCN = K+ + CN-
Cr2(SO4)3 = 2Cr3+ + 3SO 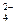
CuCl2 = Cu2+ + 2Cl–
Следует отметить, что данная модель является лишь первым очень грубым приближением, особенно для солей с небольшой долей ионности связи.
Диссоциация кислых солей происходит сначала с образованием катиона и гидроаниона, затем возможно отщепление Н+ от гидроаниона:
NaНСO3 = Na+ + HСO 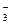
HСO 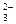 ⇄ H+ + СO
⇄ H+ + СO 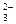
Диссоциация основных солей происходит сначала с образованием гидроксокатиона и аниона, далее возможно отщепление гидроксид-иона от гидроксокатиона:
(FeOH)2SO4 = 2FeOH+ + SO 
FeOH+ ⇄ Fe2+ + OH–






