При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция.
Внешняя среда – объекты, окружающие систему. Границы между системой и внешней средой могут быть как физически действительными, так и условными.
Основным объектом изучения термодинамики является система, под которой понимают совокупность объектов, отделенную от всех других, которая подвергается теоретическому или экспериментальному изучению.
Система бывает:
· открытой, если через границу, разделяющую систему и внешнюю среду, может происходить обмен веществом и энергией (например, жидкость и ее пар).
· закрытой, если она может обмениваться с внешней средой энергией и не может обмениваться веществом (например, газ в баллоне).
· изолированной, е система не в состоянии обмениваться в внешней средой ни веществом, ни энергией. (например, запаянная ампула, полностью изолированная от внешней среды).
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, протекающих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа) А. Теплота и работа измеряются в джоулях (Дж), килоджоулях (кДж) и мегаджоулях (МДж) и т.д.
При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы определяется параметрами состояния (давление (р), температура (Т), объем (V), химическое количество вещества (п), состав системы и др.). Экстенсивные параметры зависят от количества вещества, находящегося в системе (масса, оъем, энергия). Интенсивные параметры не зависят от количества вещества, находящегося в системе (температура, плотность, давление). Состояние системы и происходящие в ней изменения характеризуются функциями состояния (внутренняя энергия (U), энтальпия (Н), энтропия (S), энергия Гиббса (G) и др.), зависящими от параметров состояния системы и не зависящих от пути перехода системы из одного состояния в другое.
В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени.
Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, Т.е. очень медленно, а в идеале - бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарическими (р = const);
б) изохорическими (V= const);
в) изотермическими (Т= const);
г) изобарно-изотермическими (р = const, Т= const) и т.д.
Под внутренней энергией системы (U) в термодинамике понимают ее полную энергию, которая складывается из энергии поступательного, колебательного и ·вращательного движения, энергии притяжения и отталкивания всех частиц системы, исключая потенциальную энергию ее положения и кинетическую энергию движения системы как целого. Поскольку не определен условный нуль для внутренней энергии, то установить можно лишь ее изменение как разность значений внутренней энергии системы в конечном U2 и начальном U1 состоянии т.е.
ΔU = U2 – U1,
где U2 и U1 - внутренняя энергия системы в конечном и начальном состояниях.
Если в ходе химической реакции внутренняя энергия системы понижается (ΔU < О), то происходит выделение некоторого количества теплоты во внешнюю среду (экзотермическая реакция). Если же внутренняя энергия системы повышается (ΔU > 0), то реакционная система поглощает энергию из внешней среды (эндотермическая реакция). Чем больше изменение внутренней энергии, тем значительнее по величине тепловой эффект реакции.
Изменение внутренней энергии можно измерить с помощью работы и теплоты, так как система может обмениваться с окружающей средой веществом или энергией в форме теплоты Q и работы А.
Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества от одной системы к другой или от одного тела к другому.
Работа А является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных.
Положительной (А > О) считается работа, совершаемая системой против действия внешних сил, и теплота (Q > О), подводимая к системе. В отличие от внутренней энергии, работа и теплота зависят от способа проведения процесса, т.е. они являются функциями пути.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ΔU + А (1)
Выражение (1) означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую.
Энтальпия системы и ее изменение. Работу А можно разделить на два слагаемых: работу расширения pΔV (p = const) и другие виды работ A', кроме работы расширения:
А= А' + pΔV, (2)
где р - внешнее давление; ΔV - изменение объема (ΔV = V2 – V1); V2 - объем продуктов реакции; V1 - объем исходных веществ. Соответственно уравнение (1) при постоянном давлении запишется в виде:
Qp = ΔU + А' + pΔV. (3)
Если на систему не действуют никакие другие силы, кроме постоянного давления, т.е. при протекании химического процесса единственным видом работы является работа расширения, то А' =0.
в этом случае уравнение (3) запишется:
Qp = ΔU + pΔV (4)
Подставив ΔU = U2 – U1 получим:
Qp = U2 – U1 + pV2 - pV1 = (U2 + pV2) - (U1 + pV]). (5)
Характеристическая функция
U + pV =Н (6)
называется энтальпией системы. Энтальпия – теплосодержание, т.е. количество теплоты, которое необходимо придать системе, чтобы перевести ее от абсолютного нуля (Т =0 К) до заданной температуры. Энтальпия- одна из термодинамических функций, характеризующих систему, находящуюся при постоянном давлении. Подставив уравнение (6) в (5), получим:
Qp = Н2 – Н1 = ΔН. (7)
Как видно из уравнения (7), в случае изобарического процесса (р= const), теплота, подведенная к системе, равна изменению энтальпии системы. Как и другие характеристические функции, энтальпия зависит от количества вещества, поэтому ее изменение (ΔН), обычно относят к 1 моль и выражают в кДж/моль.
Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции ( энтальпией реакции).
Если система находится в изохорических условиях (V= const, ΔV= 0), то из уравнения (3) следует:
Qv= ΔU, (8)
Т.е. в этом случае тепловой эффект химической реакции равен изменению внутренней энергии системы.
Поскольку в большинстве случаев химические реакции протекают при постоянном давлении, то в дальнейшем, кроме особо оговоренных исключений, будут рассмотрены изобарические условия. Тепловой эффект реакции будем называть также энтальпией реакции и обозначать ΔН. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект реакции называется стандартной энтальпией реакции обозначается ΔНо. За стандартное состояние вещества принимают такое его физическое состояние, в котором чисто вещество наиболее устойчиво придавлении 1 атм и определенной температуре. Температура может быть любой постоянной, но чаще всего это 298 К.
Стандартное состояние веществ не зависит от температуры. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается- (ΔН < О), то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии системы (ΔН > О), называется эндотермической. Основные эндотермические и экзотермические физические и химические процессы, с которыми наиболее часто приходится сталкиваться при решении термодинамических задач приведены в табл. 2.
Таблица 2
| Процесс | Тепловой эффект | |
| эндотермический | экзотермический | |
| Физический | ||
| Плавление | х | |
| Испарение | х | |
| Возгонка | х | |
| Адсорбция | х | |
| Десорбция | х | |
| Абсорбция | х | |
| Жидкокристаллический переход | х | |
| Химический | ||
| Диссоциация | х | |
| Атомизация | х | |
| Ионизация | х | |
| Присоединение электрона к нейтральной частице (сродство к электрону) | х | |
| Образование вещества из атомов | х | |
| Образование кристаллической решетки | х | |
| Разрушение кристаллической решетки | х | |
| Хемосорбция | х | |
| Десольватация | х | |
| Дегидратация | х | |
| Разложение | х | х |
| Окислительная деструкция | х | |
| Окисление в газовой атмосфере | х | |
| Восстановление в газовой атмосфере | х | |
| Реакции окисления-восстановления | х | х |
| Реакции в твердой фазе | х | х |
| Горение | х | |
| Полимеризация | х | |
| Отверждение смол | х | |
| Каталитические реакции | х |
Тепловой эффект реакции зависит (хотя и относительно мало) от температуры; поэтому в индексе обычно указывается температура ΔНо т, или ΔНо298. Зависимость изменения энтальпии от температуры может быть представлена следующим выражением (так называемый закон Кирхгофа):
ΔН2 = ΔН1 + Т1Т2 ∫ ΔСр dT,
Где ΔСр – изменение теплоемкости системы.
Теплоемкость – количество теплоты, необходимое для нагревания единицы массы вещества на 1 К. Для аналитических вычислений обычно пренебрегают зависимостью теплоемкости от температуры, т.е. считают, что ΔСр ≈ ΔСр298. В этом случае закон Кирхгоффа будет иметь вид:
ΔН2 = ΔН1 + ΔСр298 (Т2 – Т1),
Если принять допущение, что сумма теплоемкостей начальных и конечных продуктов равны, т.е. ΔСр = 0, следовательно
ΔН2 = ΔН1 = const., т.е. тепловой эффект не зависит от температуры.
D Н 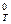 ≈ D Н
≈ D Н  ,
,
На тепловой эффект также влияет давление. Однако, в пределах давлений, используемых в практике, эффект давления для большинства реакций относительно невелик.
Энтальпия (теплота) образования. Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при 298 К u давлении 101,325 кПа, называют энтальпией (теплотой) образования. Энтальпию образования вещества В обозначают ΔНоf,298 .
Энтальпию образования простых веществ, устойчивых при 298 К и давлении 101,325 кПа, принимают равной нулю.
Нулевое значение энтальпии образования имеет фаза или модификация вещества, наиболее устойчивая при 298 К и давлении 100 кПа, например, газообразный кислород, жидкий бром, белый фосфор, белое олово, ромбическая сера. Например: ΔНоf,298(О2)=0 кДж/моль, но ΔНоf,298 (О3)=142,3 кДж/моль.
Тепловые эффекты реакций образования веществ в стандартном состоянии называют стандартными энтальпиями образования ΔНоf,298 .. Эти величины определены с той или иной степенью точности для нескольких тысяч веществ и приведены в справочниках. Если стандартная энтальпия образования отрицательна, соединение более устойчиво, чем простые вещества, из которых оно образовалось. Если она положительна, соединение менее устойчиво, чем простые вещества, образовавшие его.
Эндотермические соединения (ΔНоf,298 >0) неустойчивы и склонны к распаду. Получают их, как правило косвенным путем.
В ряду однотипных соединений, чем меньше ΔНоf,298, тем больше его термическая устойчивость относительно разложения на простые вещества. Так в ряду
ZnO (ΔНоf,298 = -350,6кДж/моль) - CdO (ΔНоf,298 = -260кДж/моль)- HgO(ΔНоf,298 = -90,9кДж/моль) устойчивость соединений уменьшается.
Энтальпия сгорания вещества (ΔНосг,298 ) соответствует изменению энтальпии при сгорании в кислороде 1 моль вещества в его стандартном состоянии при температуре 298 К и давлении 1 атм. При этом продуктами сгорания органических веществ считают углекислый газ и воду; другие продукты принято указывать дополнительно.
(C3H6) + 9/2 (O2) → 3(CO2) + 3 {H2O}, ΔНосг,298 = -2219,7кДж
Стандартные энтальпии сгорания некоторых соединений приведены в справочной литературе.
Изменение фазового состояния вещества (например, плавление, испарение, сублимация) всегда приводит к изменению энтальпии. Температура, при которой происходит фазовое превращение называется температурой перехода.
Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции при постоянных температуре и давлении зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий.
ΔНо1


 Сграфит + О2 СО2
Сграфит + О2 СО2
ΔНо2 ΔНо3
СО + ½ О2
ΔНо1 = ΔНо2 + ΔНо3
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать, умножать на численные множители.
Обычно в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (D Н  ) равен сумме стандартных теплот образования (D Н
) равен сумме стандартных теплот образования (D Н  ) продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов:
) продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов:
D Н  =
=  –
–  .
.
Уравнение реакции, в котором приведено значение теплового эффекта, называется термохимическим. В термохимическом уравнении указываются также агрегатные состояния и полиморфные модификации веществ, например:
(СО2) + [Cграфит] = 2(СО); D Н  = 172,47 кДж.
= 172,47 кДж.
При вычислении тепловых эффектов (изменения стандартных энтальпий) различных процессов необходимо:
1) записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции;
2) расставить стехиометрические коэффициенты;
3) выписать из справочника значения стандартных энтальпий образования D Н  всех участвующих в реакции веществ в соответствующих агрегатных состояниях;
всех участвующих в реакции веществ в соответствующих агрегатных состояниях;
4) используя следствие из закона Гесса, рассчитать тепловой эффект (D Н  ) процесса.
) процесса.
Пример 1. Вычислите тепловой эффект реакции горения аммиака:
 .
.
Напишите термохимическое уравнение реакции.
Решение. Записываем табличные значения теплот образования исходных веществ и продуктов реакции, под формулами веществ в уравнении реакции:

| ||||
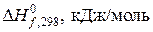
| –45,9 | 91,3 | –241,8 |
Рассчитываем тепловой эффект реакции, используя следствие из закона Гесса:
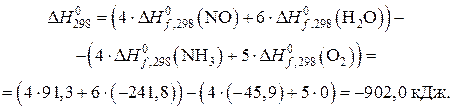
Термохимическое уравнение реакции будет иметь вид:

Поскольку  , следовательно, реакция экзотермическая.
, следовательно, реакция экзотермическая.
Процессы испарения, сублимации, плавления, диссоциации веществ на атомы – эндотермические процессы. Например, процесс испарения воды:
{H2O} = (H2O)
D H  , кДж/моль –285,84 –241,98;
, кДж/моль –285,84 –241,98;
D H  = (–241,98) – (–285,84) = 43,86 кДж.
= (–241,98) – (–285,84) = 43,86 кДж.
Тепловые эффекты реакций, протекающих в растворах, рассчитывают, используя сокращенные ионно-молекулярные уравнения соответствующих процессов. Стандартные теплоты образования ионов – величины относительные, так как условно принято за ноль значение стандартной энтальпии образования иона водорода. Значения D H 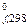 ионов также приведены в справочной литературе.
ионов также приведены в справочной литературе.
Тепловой эффект реакции D H  (D H
(D H  ) не является критерием самопроизвольного протекания той или иной реакции.
) не является критерием самопроизвольного протекания той или иной реакции.
Другой важной характеристикой химических процессов является энтропия. Возможность самопроизвольного протекания химического процесса определяется двумя факторами: стремлением системы к понижению внутренней энергии за счет экзотермической реакции (-D H  ) и стремлением системы к увеличению неупорядоченности в расположении частиц за счет теплового движения. При низких температурах преобладает стремление к минимуму энергии. При высоких температурах за счет усиления хаотического движения частиц вещества главную роль начинает играть фактор повышения неупорядоченности, мерой которой является функция состояния, называемая энтропией.
) и стремлением системы к увеличению неупорядоченности в расположении частиц за счет теплового движения. При низких температурах преобладает стремление к минимуму энергии. При высоких температурах за счет усиления хаотического движения частиц вещества главную роль начинает играть фактор повышения неупорядоченности, мерой которой является функция состояния, называемая энтропией.
Энтропия ( S) - термодинамическая функция, однозначно характеризующая состояние системы независимо от ее предыстории. Она является количественной мерой неупорядоченности системы, мерой хаотического движения и взаимного расположения частиц. Энтропия зависит от природы вещества, его количества (концентрации), давления и температуры. В отличие от внутренней энергии и энтальпии можно определить абсолютное значение энтропии.
В изолированных системах (где обмен с окружающей средой энергией и массой невозможен) процессы самопроизвольно протекают лишь в сторону повышения энтропии (второе начало термодинамики), Т.е. в изолированных системах изменение энтропии может использоваться для определения направления самопроизвольного протекания процесса.
Энтропия вещества в определенном состоянии (при заданных параметрах) в определенном агрегатном состоянии (газ, жидкость, твердое) пропорциональна логарифму термодинамической вероятности нахождения вещества в этом состоянии (уравнение Больцмана):
S = k ln W,
Где k = R / NA, W – термодинамическая вероятность состояния, которая определяется числом микросостояний, с помощью которых может быть реализовано данное макросостояние.
При абсолютном нуле Т=0К, движение прекращается, положение частиц остается неизменным и вероятность состояния системы может быть только одна. Следовательно S=0.
Третье начало термодинамики гласит, что энтропия беспримесного идеального кристаллического тела при температуре 0 К равна нулю.
Стандартной считается энтропия, отнесенная к 1 моль вещества при стандартных условиях (давление 1 атм (101,32 кПа) и температура 298 К (25ОС)). Значения стандартных энтропий для большинства химических соединений представлены в справочной литературе. Единицей измерения энтропии является (Дж /(моль. К).
Зависимость энтропии от температуры связана с теплоемкостью изобарного (р = const и Δр = О) процесса (ΔСр) и определяется (если считать теплоемкость величиной, не зависящей от температуры) следующим уравнением:

Поскольку D S 0 незначительно зависит от температуры, то D S 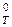 » D S
» D S  .
.
Оценить знак изменения энтропии в различных процессах можно, даже не проводя расчетов.
Так, при подводе тепла неупорядоченность в расположении отдельных структурных единиц системы увеличивается и энтропия растет. Степень увеличения неупорядоченности системы и рост ее энтропии зависят от количества подведенной теплоты и температуры. В ходе превращения твердого вещества в жидкое, а затем в газообразное, неупорядоченность системы, а следовательно, и энтропия увеличиваются (ΔS> О), так как возможности поступательного, колебательного, вращательного движения в системе существенно возрастают. Процессы испарения, плавления, расширения газа, разрыва связей между атомами сопровождаются увеличением энтропии. Процессы, сопровождающиеся увеличением упорядоченности системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. п. приводят к уменьшению энтропии.
Энтропия возрастает (D S > 0), если протекание реакции сопровождается увеличением объема (D V > 0):

Если протекание реакции сопровождается снижением объема (D V < 0)
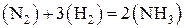 ,
,
то энтропия уменьшается (D S < 0).
Если при протекании реакции объем газа не изменился (D S ~ 0)
[S]+(O2) = (SO2)
Для различных процессов изменение стандартной энтропии (DS  ) рассчитывают по формуле:
) рассчитывают по формуле:
D S  =
=  –
–  .
.
Обозначения: D S  (D S
(D S 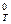 ) – изменение стандартной энтропии реакции.
) – изменение стандартной энтропии реакции.
S  – стандартная энтропия вещества или иона.
– стандартная энтропия вещества или иона.
S 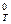 – стандартная энтропия вещества или иона при температуре, отличной от 298 К.
– стандартная энтропия вещества или иона при температуре, отличной от 298 К.
Размерность S  – Дж/(К × моль); D S
– Дж/(К × моль); D S  – Дж/К.
– Дж/К.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка определяется произведением Т × D S 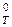 (энтропийный фактор)
(энтропийный фактор)
Поскольку D S 0 незначительно зависит от температуры, то
Т × D S 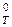 » Т × D S
» Т × D S  .
.






