Система, состоящая из двух и более веществ, одно из которых распределено в виде очень мелких частиц в другом, называется дисперсной системой. Распределенное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза,- дисперсионной средой.
Дисперсионная среда и дисперсная фаза могут быть в различных агрегатных состояниях:
| Дисперсионная среда | Дисперсная фаза | Пример системы |
| Газ | Жидкость Твердое тело Газ | Туман Дым, пыль Пена |
| Жидкость | Жидкость Твердое тело | Эмульсия жира в воде (молоко) Суспензия глины в воде |
| Твердое тело | Жидкость Твердое тело Газ | Твердые эмульсии Сплавы Твердые пены |
Свойства дисперсных систем в значительной мере зависят от степени размельчения дисперсной фазы. Различают грубодисперсные системы (взвеси) с размером частиц более 10-5 см и тонкодисперсные (коллоидные) с размерами частиц от 10-5 до 10-7 см.
Грубодисперсные системы – суспензии, эмульсии – кинетически неустойчивы: они с течением времени разделяются на дисперсионную фазу и дисперсную среду. Частицы тонкодисперсных систем находятся в непрерывном хаотическом тепловом движении. При дальнейшем дроблении вещества до молекул и ионов поверхность раздела исчезает, исчезает гетерогенность и появляется однофазная система – истинный раствор.
Истинные растворы (или просто растворы) – однородная система переменного состава, содержащая два и большее число компонентов.
Компонент - это такая составная часть системы, которая является химически однородным веществом, может быть выделена из системы и может существовать в изолированном состоянии в течение длительного времени.
Компонент, взятый в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке, – растворенным веществом.
В зависимости от состава и природы растворенных веществ растворы классифицируются:
1) по агрегатному состоянию: жидкие, твердые, газообразные. Жидкие растворы-растворы-системы, состоящие из растворителя и одного или нескольких, растворенных веществ (газы, жидкости, твердые вещества). Например, раствор сульфата меди в воде, раствор хлороводорода в воде, раствор эфира в спирте. Примером твердых растворов могут служить сплавы металлов (латунь-сплав меди и цинка). Газообразные растворы-смеси газов, например воздух (примерный состав по объему: 21% кислорода, 78% азота и 1% других газов). Наиболее распространены жидкие растворы (водные и неводные). В водных растворах растворителем является вода, в неводных растворителем (сольвентом) являются другие жидкости (бензол, спирт и т.д.)
2) по содержанию растворенного вещества: разбавленные и концентрированные. Принято считать, что в концентрированном растворе массовая доля растворенного вещества больше 20-30%.
3) по степени насыщенности: насыщенные, ненасыщенные и пересыщенные растворы. Насыщенный раствор- раствор, находящийся в равновесии с растворяемым веществом. В насыщенном растворе концентрация вещества определяется его растворимостью при данных условиях. Растворы с меньшей концентрацией называются ненасыщенными. Раствор, содержащий вещества больше, чем это определяется его растворимостью при данных условиях, называется пересыщенным.
Растворение - сложный физико-химический процесс, в котором происходит взаимодействие молекул растворителя с частицами растворенного вещества. В результате этого взаимодействия образуются сольваты.
Сольваты – продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя. Если растворителем является вода, то образующиеся сольваты называются гидратами.
Процесс образования сольватов называется сольватацией, образования гидратов – гидратацией. Примером процесса гидратации может служить растворение кристаллического NaCl в воде с образованием гидратированных ионов.
NaCl(к)+ aq ® {Na}+aq + {Cl}-aq
При растворении сульфата меди (II) (CuSO4) (вещества белого цвета) в воде происходит гидратация образующихся ионов, в результате чего раствор приобретает голубую окраску. При выпаривании раствора образуются кристаллогидраты сульфата меди (II), например CuSO4.5H2O.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в их состав, кристаллизационной водой.
Доказательством физико-химического характера процесса растворения являются тепловые эффекты. Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический – с выделением. Если в результате гидратации (сольватации) выделяется теплоты больше, чем ее поглощается при разрушении структуры вещества (физический процесс), то растворение – экзотермический процесс (растворение KOH, H2SO4).
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение – эндотермический процесс (растворение KCl, NaNO3, K2SO4)
Количественный состав растворов выражается разными способами.
1.Массовая доля растворенного вещества w(Х) – безразмерная величина, равная отношению массы растворенного веществак массе раствора:
w(Х)=  или w(Х)=
или w(Х)= 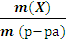 .100%,
.100%,
где m (X) – масса вещества Х в растворе; m (р-ра) – масса раствора.
Массовая доля выражается в процентах или долях единицы.
Например, форма записи «раствор NaOH с массовой долей w(NaOH) = 10%» означает, что 10 г NaOH содержится в 100 г раствора. Масса воды в нем равна 90 г.
2. Молярная концентрацияС (Х) – это концентрация, которая показывает число молей вещества, содержащегося в 1 л раствора. Например, форма записи C (H2SO4) = 2 моль/л или 2 М H2SO4 означает, что 2 моля H2SO4 содержится в 1 л раствора. Молярная концентрация рассчитывается как:
 ,
,
где С (Х) – молярная концентрация растворенного веществаХ, моль/л; n (X) – количество растворенного вещества Х, моль; V р-ра – объем раствора, л; m (X) – масса растворенного вещества, г; М (Х) – молярная масса вещества, г/моль.
3. Молярная концентрация эквивалента (нормальная концентрация)  – это концентрация, которая показывает количество вещества эквивалента, содержащегося в 1 л раствора. Например, форма записи 0,5 н. Са(ОН)2, или
– это концентрация, которая показывает количество вещества эквивалента, содержащегося в 1 л раствора. Например, форма записи 0,5 н. Са(ОН)2, или 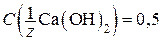 моль/л, означает, что 0,5 моля эквивалента Са(ОН)2 содержится в 1 л раствора. Эта концентрация рассчитывается как:
моль/л, означает, что 0,5 моля эквивалента Са(ОН)2 содержится в 1 л раствора. Эта концентрация рассчитывается как:
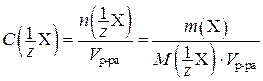 ,
,
где  – нормальная концентрация, моль/л;
– нормальная концентрация, моль/л;  – количество вещества эквивалента, моль; V р-ра – объем раствора, л; m (X) – масса растворенного вещества, г;
– количество вещества эквивалента, моль; V р-ра – объем раствора, л; m (X) – масса растворенного вещества, г;  – молярная масса эквивалента вещества, г/моль.
– молярная масса эквивалента вещества, г/моль.
4. Моляльная концентрация b( X ) – это концентрация, которая показывает число молей растворенного вещества в 1 кг растворителя и выражается в молях на килограмм. Форма записи 0,2 m NaCl означает, что 0,2 моля NaCl содержится в 1 кг растворителя (например, воды). Моляльная концентрация рассчитывается как:
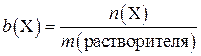 ,
,
где b (X) – моляльная концентрация раствора, моль/кг; n (Х) – число молей растворенного вещества, моль; m (растворителя) – масса растворителя, кг.
5. Молярная доля растворенного вещества x – отношение химического количества вещества Х к общему числу моль всех веществ в растворе.
 ,
,
где n (Х) – количество вещества Х в растворе, моль; ni – количество вещества каждого компонента раствора, моль.
Молярная доля выражается в долях единицы или процентах.
Пример 1. Найти массовую долю (%), мольную долю, молярность, нормальность, моляльность MgSO4 в растворе, 1000 г которого содержит 198г MgSO4 (rр-ра=1,215 г/мл).
Решение.
1.Находим массовую долю раствора:
w(MgSO4)=  или 19,8%
или 19,8%
2.Мольная доля:
n(MgSO4)= 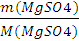 =
= 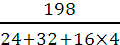 =1,65 моль,
=1,65 моль,
m(H2O)=mр-ра-m(MgSO4)=1000-198=0,802 кг.
n(H2O)=  =
=  =44,56 моль;
=44,56 моль;
X(MgSO4)= 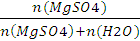 =
= 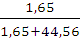 =0,0357;
=0,0357;
3.Молярная концентрация:
Vр-ра= 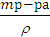 =
=  =0,823 л;
=0,823 л;
С(MgSO4)- 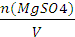 =
=  =2,0 моль/л.
=2,0 моль/л.
4. Нормальная концентрация
C( MgSO4)=z
MgSO4)=z  C(MgSO4)=2
C(MgSO4)=2  2,0=4,0 моль/л.,
2,0=4,0 моль/л.,
5. Моляльная концентрация (растворитель вода, его масса в кг):
Сm(MgSO4)  =
=  =2,06 моль/кг.
=2,06 моль/кг.
Пример 2. Вычислите молярную и нормальную концентрации серной кислоты в растворе с w(H2SO4) = 40%. Плотность раствора ρр‑ра = 1,303 г/см3.
Решение. Принимаем объем раствора за 1 л или 1000 мл.
Определяем массу 1 л раствора:
m р-ра = 1000 ∙ 1,303 = 1303 г.
Находим массу H2SO4 в этом растворе:
 г.
г.
Рассчитываем молярную концентрацию раствора:
 моль/л.
моль/л.
Определяем нормальную концентрацию раствора H2SO4. Фактор эквивалентности H2SO4 равен  :
:
 .
.
Молярная масса эквивалента H2SO4 составляет
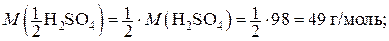
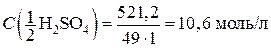 .
.
Пример 3. Какой объем раствора фосфорной кислоты с w(H3PO4) = 85% (ρр-ра = 1,84 г/см3) требуется для приготовления 0,5 л 3 н. раствора H3PO4?
Решение. Вычисляем массу H3PO4 в 0,5 л раствора:


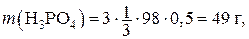
где M (H3PO4) = 98 г/моль; 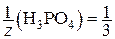 .
.
Определяем, какая масса раствора H3PO4 с w(H3PO4) = 85% содержит 49 г фосфорной кислоты:

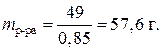
Зная плотность раствора, находим его объем:







