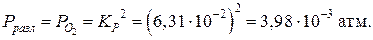Для учета одновременного влияния энтальпийного (D Н  ) и энтропийного факторов при постоянных давлении и температуре используют так называемую энергию Гиббса (свободную энергию, uзобарно-uзоmермический потенциал):
) и энтропийного факторов при постоянных давлении и температуре используют так называемую энергию Гиббса (свободную энергию, uзобарно-uзоmермический потенциал):
D G  = D Н
= D Н  – Т × D S
– Т × D S 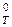 ,
,
где D G 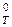 – изменение стандартной энергии Гиббса при температуре Т.
– изменение стандартной энергии Гиббса при температуре Т.
Расчет изменения стандартной энергии Гиббса обычно проводят по приближенному уравнению:
D G 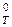 » D Н
» D Н  – Т D S
– Т D S  .
.
Обозначения: D G  – изменение стандартной энергии Гиббса в реакции;
– изменение стандартной энергии Гиббса в реакции;
D G 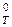 – изменение стандартной энергии Гиббса в реакции при температуре Т;
– изменение стандартной энергии Гиббса в реакции при температуре Т;
D G 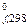 – стандартная энергия Гиббса образования веществ и ионов из простых веществ. D G
– стандартная энергия Гиббса образования веществ и ионов из простых веществ. D G 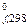 – изменение энергии Гиббса реакции образования 1 моля вещества из простых веществ при условии, что все участники реакции находятся в стандартных состояниях.
– изменение энергии Гиббса реакции образования 1 моля вещества из простых веществ при условии, что все участники реакции находятся в стандартных состояниях.
Единицы измерения D G 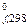 – кДж/моль; D G
– кДж/моль; D G 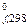 – кДж.
– кДж.
Для расчета D G  и процесса необходимо:
и процесса необходимо:
1) записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции;
2) расставить стехиометрические коэффициенты;
3) выписать из справочника величины стандартных теплот образования и стандартных энтропий всех участвующих в реакции веществ в соответствующих агрегатных состояниях;
4) рассчитать значения D Н  и D S
и D S  реакций, как указано выше, и, подставив их в уравнение D G
реакций, как указано выше, и, подставив их в уравнение D G  = D Н
= D Н  – 298·D S
– 298·D S  , найти значение D G
, найти значение D G  . Как и любая термодинамическая функция, энергия Гиббса является функцией состояния, т.е. ее значение не зависит от пути протекания процесса, а лишь от исходного и конечного состояний системы. Поэтому энергию Гиббса химической реакции можно рассчитать как сумму энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Так как в таблицах приведены значения D G
. Как и любая термодинамическая функция, энергия Гиббса является функцией состояния, т.е. ее значение не зависит от пути протекания процесса, а лишь от исходного и конечного состояний системы. Поэтому энергию Гиббса химической реакции можно рассчитать как сумму энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Так как в таблицах приведены значения D G 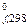 , то использовать такой расчет можно лишь для D G
, то использовать такой расчет можно лишь для D G  .
.
5) При расчете D G 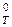 пренебрегают зависимостью D Н 0 и D S 0 от температуры и рассчитывают DG
пренебрегают зависимостью D Н 0 и D S 0 от температуры и рассчитывают DG 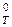 по приближенному уравнению
по приближенному уравнению
D G 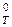 » D Н
» D Н  – Т D S
– Т D S  .
.
По величине изменения энергии Гиббса в реакции можно судить о принципиальной термодинамической возможности осуществления процесса. Процесс термодинамически невозможен как самопроизвольный при D G 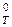 >> 0 (>40 кДж). Если D G
>> 0 (>40 кДж). Если D G 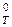 << 0 (<–40 кДж), то процесс термодинамически возможен. Значения D G
<< 0 (<–40 кДж), то процесс термодинамически возможен. Значения D G 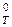 от –40 кДж до +40 кДж соответствуют обратимым процессам. При условии D G
от –40 кДж до +40 кДж соответствуют обратимым процессам. При условии D G 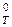 = 0 оба направления процесса равновероятны. Температура, при которой прямой и обратный процессы равновероятны, может быть определена в соответствии с формулой:
= 0 оба направления процесса равновероятны. Температура, при которой прямой и обратный процессы равновероятны, может быть определена в соответствии с формулой:
Т = 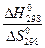 .
.
Энергия Гиббса химической реакции связана с константой равновесия реакции уравнением
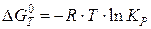 ,
,
где R – универсальная газовая постоянная, 8,31 Дж/(моль ∙ К); KP – константа равновесия реакции, выраженная через парциальные давления.
Если в этом уравнении перейти от натурального логарифма к десятичному и подставить постоянную R, то получим уравнение:
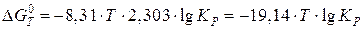
Полученное уравнение используются для вычисления константы равновесия реакции и давления разложения веществ. Давление разложения вещества (P разл) – это равновесное давление газообразных продуктов обратимой реакции разложения вещества. Например, для реакций
[HgO]«{Hg}+0,5 (O2), Pразл= PO2
[Ca(OH)2] «[CaO] +(H2O), Pразл= PH2O
Пример 2. Установите, возможна ли реакция взаимодействия водяного пара с хлором
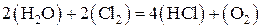
при 1000 К? Определите температуру, при которой реакция становится термодинамически возможной.
Решение.
Для определения термодинамической возможности протекания реакции при 1000 К нужно вычислить энергию Гиббса реакции при этой температуре. Ее можно рассчитать по уравнению, используя значения энтальпии и энтропии реакции при стандартной температуре. Записываем табличные значения теплот образования и абсолютных стандартных энтропий исходных веществ и продуктов реакции под формулами веществ в уравнении реакции:
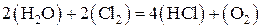
| ||||
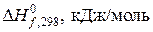
| –241,8 | –92,3 | ||
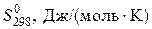
| 188,8 | 223,1 | 186,9 | 205,2 |
Рассчитываем энтальпию реакции при 298 К по уравнению:
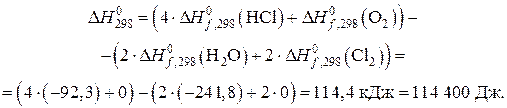
Вычисляем энтропию реакции при 298 К по уравнению:
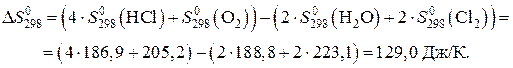
Находим энергию Гиббса реакции при 1000 К по уравнению:
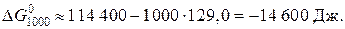
Поскольку 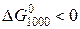 , следовательно при температуре 1000 К реакция термодинамически возможна.
, следовательно при температуре 1000 К реакция термодинамически возможна.
Для определения температуры, при которой реакция становится термодинамически возможной, используем условие:
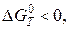
или
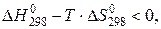
откуда
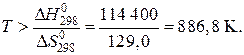
Пример 3. Рассчитайте давление разложения PbO2 по реакции
[PbO2]«[PbO]+0,5(O2)
при температуре 200°С.
Решение. Давление разложения для данной реакции будет равно давлению кислорода
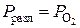 .
.
Выражение константы равновесия для данной реакции
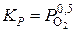 .
.
Из последнего выражения находим давление кислорода:
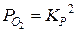 .
.
Константу равновесия KP можно выразить из уравнения, зная энергию Гиббса реакции при данной температуре. Переведем температуру в градусы Кельвина:
T = 273 + 200 = 473 К.
Вычисляем энергию Гиббса реакции при 473 K:
| [PbO2]«[PbO]+0,5(O2) | |||
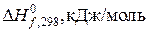
| –277,4 | –219,0 | |
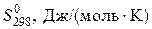
| 68,6 | 66,5 | 205,2 |
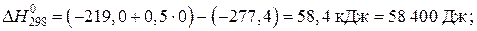
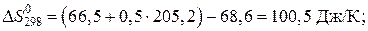
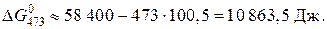
Выражаем из уравнения, приведенного выше, константу равновесия реакции:
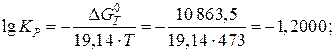
(расчет 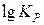 проводится до 4-го знака после запятой);
проводится до 4-го знака после запятой);
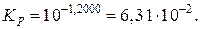
Тогда давление разложения будет равно: