




Br2 + H2S = S + 2HBr,
O2 + 4Fe(OH)2 + 2H2O = 4Fe(OH)3
KClO3 + 6FeSO4 + 3H2SO4 = KCl + 3Fe2(SO4)3 + 3H2O;
HIO3 + 5HI = 3I2 + 3H2O.

MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.

Mg + 2HCl = MgCl2 + H2;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2.

5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O.

2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8Н2О.
Расстановку коэффициентов в ОВР можно осуществить:
1) методом электронного баланса (для твердофазных реакций, реакций в газовой фазе, в растворах);
2) методом ионно-электронного
баланса, или методом полуреакций (для реакций в растворах).
Электронный баланс – метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами, изменяющими свою степень окисления. Число электронов, отданных восстановителем, равно числу электронов, полученных окислителем.
Рассмотрим метод электронного баланса на примере реакции
KMnO4 + HCl ®
Уравнение составляется в несколько стадий.
1. Записывают схему реакции:
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
2. Указывают степени окисления над символами элементов:

3. Выделяют элементы, изменяющие степени окисления, и определяют число электронов, приобретаемых окислителем и отдаваемых восстановителем:
Mn+7 + 5e– = Mn+2
2Cl–1 – 2e– = Cl20
4. Уравнивают число приобретаемых и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления:
| НОК | ДМ | ||
| Mn+7 + 5e– = Mn+2 | |||
| 2Cl–1 – 2e– = Cl20 |
––––––––––––––––––––––––––––––––––––––
2Mn+7 + 10Cl–1 = 2Mn+2 + 5Cl20
где НОК – наименьшее общее кратное; ДМ – дополнительные множители.
5. Подбирают коэффициенты для всех остальных участников реакции:
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Электронно-ионный баланс (метод полуреакций) – метод нахождения коэффициентов, в котором рассматривается обмен электронами между реальными частицами в растворе с учетом характера среды.
Для уравнивания кислорода в ионно-молекулярных полуреакциях используют молекулы H2O, катионы H+ в кислой среде, гидроксид-ионы OH– в щелочной среде.
Правило кислой среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по одной молекуле H2O, а в противоположную часть – необходимое для уравнивания водорода число катионов H+.
Правило щелочной среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по два гидроксид-иона OH–, а в противоположную часть – необходимое для уравнивания водорода число молекул H2O.
В нейтральной среде в зависимости от продуктов реакции используется или правило кислой среды, или правило щелочной среды.
Рассмотрим пример расстановки коэффициентов этим методом для реакции
KMnO4 + HCl ®
1. Записывают схему реакции с указанием степеней окисления элементов и выделяют элементы, которые изменили свои степени окисления:

2. Приводят эту схему в ионно-молекулярной форме, чтобы определить реальные частицы, существующие в растворе:

3. Выделяют частицы, в состав которых входят элементы, изменяющие свои степени окисления:

4. Чтобы получить полуреакции, следует соблюдать баланс по числу атомов каждого элемента. Поскольку в данном примере среда кислая, для уравнивания полуреакций пользуются правилом кислой среды. В первой полуреакции в правой части не хватает четыре атома кислорода, следовательно, в эту часть записывают четыре молекулы воды. Для баланса по водороду в левую часть добавляют восемь катионов водорода. Во второй полуреакции уравнивают только число атомов хлора:

5. Определяют суммарные заряды в левых и правых частях полуреакций и добавлением или вычитанием электронов уравнивают полуреакции по зарядам:
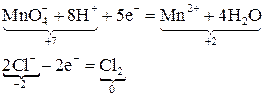
6. Устанавливают дополнительные множители для окислителя и восстановителя на основании того, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем:

7. Первую полуреакцию умножают на 2, вторую – на 5 и складывают правые и левые части полуреакций, в результате чего получают суммарное ионно-молекулярное уравнение реакции:

8. Записывают окончательное уравнение в молекулярной форме:

Пример 1. Запишите уравнение реакции следующего процесса:
H2SO4(конц.) + Mg ®
Уравняйте электронным и ионно-электронным способом.
Решение. Поскольку магний относится к активным металлам, то концентрированная серная кислота будет восстанавливаться до H2S:
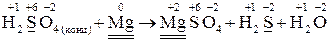
Электронный баланс:
| Mg0 – 2e– = Mg+2 | – восстановитель, процесс окисления | |||
| S+6 + 8e– = S–2 | – окислитель, процесс восстановления |
Окончательное уравнение:

Метод полуреакций.
Схема реакции в ионно-молекулярной форме:

Записываем полуреакции в соответствии с правилом кислой среды и электронным балансом:

В молекулярной форме:

Пример 2. Запишите уравнение реакции взаимодействия перманганата калия с нитритом натрия в присутствии гидроксида калия. Уравняйте ионно-электронным способом, укажите окислитель и восстановитель. Каковы внешние признаки протекающей реакции?
Решение. Окислителем является KMnO4, поскольку имеет в своем составе атом Mn+7, находящийся в максимальной степени окисления. NaNO2 ‑ восстановитель, так как у атома азота промежуточная степень окисления +3. KOH является средой. В щелочной среде ион MnO4– (Mn+7) восстанавливается до MnO42– (Mn+6). Анион NO2– (N+3) будет окисляться до NO3– (N+5). Схема реакции имеет вид:

Схема реакции в ионно-молекулярной форме:

Записываем полуреакции, используя правило щелочной среды:

Окончательное уравнение в молекулярной форме имеет следующий вид:

Фиолетовый раствор KMnO4 превращается в изумрудно-зеленый раствор K2MnO4.






