Скорость химической реакции зависит от концентрации реагирующих веществ (парциальных давлений газов), температуры, ускоряющего или замедляющего действия катализатора, а также от физических и химических свойств веществ, вступающих в химическое взаимодействие. На скорость химической реакции влияют механизм реакции, степень дисперсности реагентов, действие активирующего излучения и т. д.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенной реакции). Скорость реакции обычно определяется изменением концентраций реагирующих веществ в единицу времени (сек.):

 ;
; 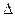 C < 0, v > 0
C < 0, v > 0
где D С – изменение концентраций реагирующих или образующихся веществ; D t – промежуток времени, в который происходит изменение концентраций веществ
Поскольку скорость реакции может быть только положительной, то знак «–» перед дробью означает, что рассматривается D С исходных веществ. Концентрация продуктов реакции возрастает, поэтому в выражении скорости реакции перед дробью ставится знак «+».
Скорость химической реакции зависит от:
1) природы реагирующих веществ,
2) концентрации реагирующих веществ (давления, если вещества газообразные),
3) температуры,
4)присутствия катализатора.
Скорость химической реакции зависит от числа соударений
Влияние концентрации реагирующих веществ описывается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Например, для гомогенной реакции
a(A) + b(B) = c(C) + d(D)
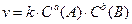 ,
,
где  – молярные концентрации веществ, моль/л; k – константа скорости реакции. Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентраций реагирующих веществ.
– молярные концентрации веществ, моль/л; k – константа скорости реакции. Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентраций реагирующих веществ.
 при
при  =1 моль/л.
=1 моль/л.
 Выражение зависимости скорости реакции от концентрации называется кинетическим уравнением.
Выражение зависимости скорости реакции от концентрации называется кинетическим уравнением.
 ,
,
Для гетерогенных реакций закон действующих масс записывается без учета твердых веществ, в кинетическое уравнение входят концентрации газообразных и жидких веществ. Если в реакции участвует твердое вещество, то реакция протекает на его поверхности. Скорость реакции зависит от площади поверхности твердого вещества или от степени его измельчения, которая входит в константу скорости реакции. Например, для реакции

выражение для скорости реакции будет иметь вид
 .
.
Если в реакции участвуют газообразные вещества, то скорость реакции зависит от давления. При повышении давления в несколько раз во столько же раз уменьшится объем, занимаемый газами, и во столько же раз увеличится концентрация каждого газообразного вещества.
Пример 1. Во сколько раз возрастет скорость реакции
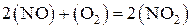
при увеличении концентрации оксида азота (II) в 3 раза?
Решение. Скорость реакции связана с концентрацией реагирующих веществ законом действующих масс, который применительно к данной реакции можно записать так:
 .
.
Пусть вначале концентрация NO равнялась С 1, тогда скорость реакции была
 .
.
После увеличения концентрации NO в 3 раза скорость реакции станет
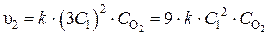 .
.
Значит скорость реакции увеличилась в
 раз.
раз.
Таким образом, скорость реакции увеличится в 9 раз.
Влияние температуры на скорость реакции определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на 10° скорость реакции возрастает примерно в 2–4 раза. Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции и обозначается g. Скорости реакции при разных температурах (t 2 и t 1) связаны следующим соотношением:
 .
.
Пример 2. Во сколько раз возрастет скорость реакции при повышении температуры с 60 до 100°С, если температурный коэффициент скорости реакции равен 2,7?
Решение. Для решения задачи используем правило Вант-Гоффа. Если принять t 2 = 100, а t 1 = 60, то можно записать, исходя из соотношения:

Значит, скорость реакции увеличится в 53 раза.
С помощью правила Вант-Гоффа можно лишь приблизительно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции от Т дает теория активации Аррениуса.
Молекулы находятся в постоянном движении, при этом происходят столкновения, но не всякое столкновение реагирующих веществ приводит к образованию продукта реакции. Для того, чтобы произошла реакция, т.е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным – не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления и разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества.
(H2) + (J2) = 2(HJ) H – H  H
H  H
H  H H
H H
J – J 
 J
J  J
J 


активир. компл.
Избыточная энергия, которой должны обладать молекулы, чтобы столкновение привело к образованию нового вещества, называется энергией активации реакции. Энергия активации является характеристикой каждой реакции и определяет влияние на скорость химической реакции природы реагирующих веществ.
С ростом температуры число активных молекул возрастает. Влияние температуры на скорость реакции в теории активации отражается уравнением Аррениуса:
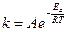 ,
,
где k – константа скорости, А – постоянный множитель Аррениуса, Еa – энергия активации, R – универсальная газовая постоянная, е – основание натурального логарифма.
Из уравнения Аррениуса следует, что снижение энергии активации приводит к значительному увеличению скорости реакции. Чтобы снизить энергию активации прибегают к использованию катализатора.
Влияние катализатора на скорость реакции.
Катализаторы – вещества, которые изменяют скорость химической реакции, участвуя в промежуточных взаимодействиях, но в результате реакции не расходуются, восстанавливают свой состав.
Чаще всего они ускоряют реакцию – положительные катализаторы, но иногда и замедляют (коррозия) – отрицательные катализаторы (ингибиторы).
Ускоряющее действие катализатора заключается в уменьшении энергии активации катализируемой реакции. Каждый из промежуточных процессов с участием катализатора протекает с меньшей Еа, чем некатализируемая реакция.
Изменение скорости катализируемой реакции за счет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ:
А + В  А…D
А…D  АВ
АВ
активир. компл.
Но в силу высокой энергии активации эта реакция протекает с очень малой скоростью. Пусть найдено такое вещество К (катализатор), которое легко вступает во взаимодействие с А (с меньшей энергией активации), образуя соединение АК:
A + K  A…K
A…K  AK
AK
активир. компл.
Соединение АК легко взаимодействует с веществом В, образуя вещества АВ и К:
B + AK  B…AK
B…AK  AB + K
AB + K
активир. компл.
Суммируя два последних уравнения, получим
А + В 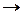 АВ,
АВ,
т.е. в результате реакции катализатор остался без изменения.
Различают два типа катализа: гомогенный – катализатор и реагирующие вещества образуют одну фазу (H2O2  H2 + O2), гетерогенный – катализатор и реагирующие вещества находятся в разных фазах. В случае гетерогенного катализа образование промежуточного реакционноспособного соединения происходит на поверхности катализатора, поэтому чем больше поверхность катализатора, тем лучше идет реакция:
H2 + O2), гетерогенный – катализатор и реагирующие вещества находятся в разных фазах. В случае гетерогенного катализа образование промежуточного реакционноспособного соединения происходит на поверхности катализатора, поэтому чем больше поверхность катализатора, тем лучше идет реакция:
(SO2) +  (O2)
(O2) 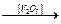 (SO3).
(SO3).
Большинство химических реакций в пищеварительной системе, в крови и в клетках животных и человека являются каталитическими. Катализаторы – ферменты – это простые и сложные белки.






