Комплексонометрически можно проводить определение многих веществ:
§ Ионы металлов с зарядом +2, +3, +4;
§ Ионы щелочных металлов;
§ Анионы, которые образуют осадкис ионами Mеn+;
§ Анионы-окислители, в состав которых входит металл в высокой степени окисления;
§ Жесткость воды;
§ Органические вещества, которые образуют осадки с ионами Mеn+.
Определение веществ, принадлежащих к разным группам, проводится по разным схемам.
Метод применяется в фармацевтическом анализе для контроля качества препаратов, которые содержат ионы металлов: алюмаг (Al3+, Mg2+); сульфат магния; глюконат, хлорид и лактат кальция; оксид и сульфат цинка; основной нитрат висмута и др.
Определение ионов Mеn+ (n = 2–4)
Прямое титрование раствором ЭДТА используют, если реакция идет быстро, есть подходящий индикатор и константа устойчивости комплексоната не меньше, чем 107–108.
Обратное титрование применяют, если реакция идет медленно, нет подходящего индикатора, а также в тех случаях, когда протекает гидролиз иона металла при оптимальном значении рН образования комплексоната. Например, ионы Cr3+ и Al3+ определяют по схеме:

В качестве второго рабочего раствора (Ме2+) используют раствор соли Mg2+, Zn2+, Cu2+ или другого металла, комплексонат которого менее устойчив, чем комплексонат определяемого металла. Так, для приведенного примера должно соблюдаться условие:

Титрование заместителя применяют в тех же случаях, что и обратное титрование. В качестве вспомогательного раствора используют раствор комплексоната магния MgY2–, т. к. он является наименее устойчивым комплексонатом и ион любого другого металла вытесняет магний из комплексоната:

Определение щелочных металлов
Поскольку ионы щелочных металлов не образуют комплексов с ЭДТА, то их сначала осаждают в виде осадков с анионами сложного состава, включающими хорошо титруемые катионы.
Например, ионы К+ – в виде K2Na[Co(NO2)6], ионы Na+ – в виде NaZn(UO2)3(CH3COO)9 ∙ 6H2O. Затем осадки растворяют в кислоте и титруют Со2+ или Zn2+ из осадка раствором ЭДТА.
Определение анионов, которые образуют осадки с ионами металлов
Комплексонометрически можно определить многие анионы, которые образуют осадки с многовалентными металлами: 
 и др.
и др.
Схемы анализа (на примере определения  ):
):
§ обратное титрование:
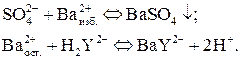
§ титрование заместителя:

Определение анионов-окислителей
Для определения анионов-окислителей 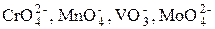 и т. п. используют метод замещения: сначала восстанавливают металл до более низкой степени окисления, а затем титруют полученный катион раствором ЭДТА:
и т. п. используют метод замещения: сначала восстанавливают металл до более низкой степени окисления, а затем титруют полученный катион раствором ЭДТА:

Определение жесткости воды
Определение жесткости воды стало первым практически важным применением ЭДТА в аналитической химии, поскольку на всех производствах, где используется вода, такой анализ должен непременно проводиться.
Жесткость воды – это суммарный показатель качества воды. Она обусловлена наличием ионов Ca2+ и Mg2+.
Общая жесткость воды показывает, сколько ммоль экв Ca2+ и Mg2+ в сумме находится в 1 л воды:
 .
.
Для ее определения пробу воды титруют стандартным раствором ЭДТА в аммиачном буфере с индикатором эриохром черным Т:
Me2+ + H2Y2– = MeY2– + 2H+.
Поскольку концентрация Ca2+ и Mg2+ в воде незначительна, то берут большую аликвоту с помощью пипеток Мора вместимостью 50,0 или 100,0 мл, которые выпускаются специально для этих целей.
Расчет результатов анализа:

В Западной Европе жесткость воды выражают в немецких градусах жесткости (° d). 1 ° d соответствует 10 мг CaO в 1 л воды. Переход к ммоль экв / л:
 Þ
Þ
1 ° d = 0,3567 ммоль экв/л.
Характеристика воды по значению общей жесткости
| Ж(Н2О), ммоль экв/л | < 4 | 4–8 | 8–12 | >12 |
| Характеристика воды | мягкая | средней жесткости | жесткая | очень жесткая |
Определение органических веществ, которые образуют осадки с ионами металлов
Комплексонометрически можно определять те органические соединения, которые образуют осадки с многовалентными металлами либо с комплексными анионами [CdI4]2–, [Zn(SCN)4]2– и др.
Рассмотрим схему анализа на примере определения лекарственного вещества суксаметония (бис -холинового эфира янтарной кислоты дихлорида дигидрата). Обозначим дикатион суксаметония Х2+.
§ Обратное титрование
К навеске препарата, растворенной в воде, добавляют точно отмеренный объем стандартного раствора K2[CdI4]:

Осадок отфильтровывают и титруют фильтрат стандартным раствором ЭДТА:

§ Титрование заместителя
К навеске препарата, растворенной в воде, добавляют избыток вспомогательного раствора K2[CdI4]:

Осадок отфильтровывают, промывают и растворяют в соответствующих условиях:
 .
.
Затем оттитровывают [CdI4]2– из осадка стандартным раствором ЭДТА:
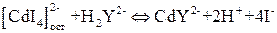
ЗАКЛЮЧЕНИЕ
Аналитик будущего – это наполовину химик, на четверть – специалист по автоматам-анализаторам и на оставшуюся четверть – специалист по математической статистике.
З. Поллер
Основа классических методов анализа – применение химических реакций для определения веществ.
Определение «классические» не следует понимать как «устаревшие». В связи с тенденцией к инструментализации аналитической химии для ряда методов, с которыми Вы познакомились, область их применения в будущем, возможно, действительно будет сокращаться. Но, несмотря на это, большинство основополагающих принципов классических методов сохраняют свое значение и в сфере «высоких аналитических технологий».
Более того, в некоторых весьма актуальных областях, например, при анализе объектов окружающей среды сейчас наблюдается возврат к классическим методам. Так, для определения одного из групповых параметров – суммы экстрагируемых органических галогенов (EOX) в почвах – требуется малоселективный метод. Самым простым способом решения этой задачи оказалось осадительное титрование галогенид-ионов раствором нитрата серебра (аргентометрия).
Выбор метода анализа зависит от химических свойств аналита и матрицы, от содержания определяемого компонента и целей проведения анализа. Инструментальные методы анализа по сравнению с классическими обладают более высокой избирательностью и более низкой границей определяемых содержаний. Химические методы характеризуются лучшей воспроизводимостью результатов анализа.
Исходя из этого, классические методы выбирают для проведения анализа, если содержание аналита в пробе достаточно высоко и результат должен быть получен с высоким уровнем точности. Если же концентрация аналита в пробе мала и решающим фактором является область определяемых содержаний методики, а не ее воспроизводимость, предпочтительнее использовать инструментальные методы анализа.
ЛИТЕРАТУРА
1. Аналитическая химия. Лабораторный практикум: учеб.-метод. пособие для студентов химико-технологических специальностей и специальностей 1-57 01 01 «Охрана окружающей среды и рациональное использование природных ресурсов», 1-57 01 03 «Биоэкология», 1-48 01 05 «Химическая технология переработки древесины» / А. Е. Соколовский [и др.]. – Минск: БГТУ, 2012. – 111 с.
2. Лурье, Ю. Ю. Справочник по аналитической химии. – М.: Химия, 1989. – 448 с.
3. Аналитическая химия. Справочные материалы: учебно-методи-ческое пособие по дисциплинам «Аналитическая химия» и «Аналитическая химия и физико-химические методы анализа» для студентов химико-технологических специальностей / сост.: А. Е. Соколовский, Е. В. Радион. – Минск: БГТУ, 2005. – 80 с.
ОГЛАВЛЕНИЕ
| введение................................................. | |
| Гравиметрический метод анализа.................. Общая характеристика метода........................... Классификация гравиметрических методов................ Этапы определения по методу осаждения.................. Расчет результатов гравиметрического определения......... Достоинства и недостатки гравиметрического метода анализа Погрешности гравиметрии.............................. Аналитические возможности гравиметрических методов..... Использование гравиметрии в анализе органических веществ. Применение гравиметрии в фармацевтическом анализе...... Современное весовое оборудование...................... | |
| Титриметрический метод анализа.................. Общая характеристика метода........................... Классификация титриметрических методов анализа......... Общая схема титриметрического анализа.................. Стандартные и вспомогательные растворы................ Способы выражения концентрации стандартных и вспомогательных растворов........................... Виды стандартных растворов и способы их приготовления... Требования к установочному веществу.................... Расчет результатов титриметрического анализа............. Определение факторов эквивалентности веществ........... Способы титрования................................... Современное оборудование для титриметрнического анализа. Кислотно-основное титрование.................. Общая характеристика метода........................... Аналитические возможности метода...................... Достоинства и недостатки метода........................ Кислотно-основное титрование в неводных средах.......... | |
| Окислительно-восстановительное титрование Общая характеристика методов.......................... Требования к ОВР в титриметрии........................ Расчет факторов эквивалентности веществ, участвующих в ОВР................................................ Перманганатометрия..................................... Общая характеристика метода........................... Приготовление и стандартизация рабочего раствора KMnO4.. Аналитические возможности метода...................... Иодометрия.............................................. Общая характеристика метода........................... Приготовление и стандартизация рабочего раствора I2....... Приготовление и стандартизация рабочего раствора Na2S2O3. Особенности использования крахмала в иодометрии........ Условия проведения иодометрических определений........ Аналитические возможности метода...................... Комплексометрическое титрование............. Комплексонометрия....................................... Общая характеристика метода........................... Приготовление и стандартизация рабочего раствора ЭДТА... Аналитические возможности метода...................... Заключение.............................................. Литература............................................... |
Учебное издание
Радион Елена Вадимовна
КЛАССИЧЕСКИЕ МЕТОДЫ АНАЛИЗА:
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
Учебное пособие
Редактор М. Д. Панкевич
Компьютерная верстка
Корректор
Издатель:
УО «Белорусский государственный технологический университет».
ЛИ № 02330/0549423 от 08.04.2009.
ЛП № 02330/0150477 от 16.01.2009.
Ул. Свердлова, 13а, 220006, г. Минск






