Иодометрия – весьма универсальный и очень точный метод, позволяющий проводить определение многих веществ:
§ окислители (Cr2O72–, Cu2+, Н2O2, активный хлор и др.);
§ восстановители (S2O32–, SO32–, NO2–, HCOH и др.);
§ вещества, не обладающие окислительно-восстановительными свойствами, но реагирующие с окислителями или восстановителями (Ba2+, Zn2+, Pb2+, Ag+ и др.);
§ кислоты (сильные и слабые с Ка > 10–6);
§ органические вещества (нафтол, аскорбиновая кислота, муравьиная кислота и др.).
Определение веществ, принадлежащих к разным группам, проводится по разным схемам.
Надо отметить, что иодометрия достаточно часто применяется в фармацевтическом анализе.
Определение окислителей
В иодометрии применяют растворы восстановителей Na2S2O3 и KI, но прямое титрование ими окислителей невозможно по следующим причинам:
§ реакции между окислителями и Na2S2O3 идут нестехиометрично;
§ реакции между окислителями и KI идут медленно. Кроме того, раствор КI неустойчив и нет возможности зафиксировать к. т. т. при титровании этим раствором (с помощью крахмала можно легко узнать, что йод в растворе появился или исчез, а узнать, что он перестал выделяться, – невозможно).
Поэтому для определения окислителей используют титрование заместителя: окислитель замещают эквивалентным количеством йода, затем титруют выделившийся йод раствором тиосульфата:

Рабочий раствор – Na2S2O3; вспомогательные растворы – KI и Н2SO4; индикатор крахмал добавляют вблизи т. э.
Определение восстановителей
В зависимости от силы восстановителя используют либо прямое, либо обратное титрование.
Прямое титрование раствором I2 в нейтральной или слабокислой среде используют для достаточно сильных восстановителей. Крахмал добавляют до начала титрования. Титруют до появления окраски.
Обратное титрование избытка I2 раствором Na2S2O3 используют для восстановителей, значение Е 0 которых близко к  , поскольку они труднее окисляются, реакция идет недостаточно полно при прямом титровании:
, поскольку они труднее окисляются, реакция идет недостаточно полно при прямом титровании:
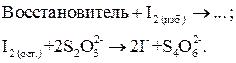
Определение веществ, не обладающих
окислительно-восстановительными свойствами
Иодометрически можно определять ионы металлов, которые осаждаются в виде сульфидов или хроматов.
Многие ионы металлов образуют нерастворимые осадки с сульфид-ионом S2–, который является хорошим восстановителем. Поэтому сначала осаждают ион металла в виде сульфида, затем растворяют осадок в HCl в присутствии избытка I2 и титруют остаток I2 после реакции раствором Na2S2O3:
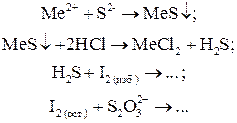
В этой схеме анализа используется обратное титрование заместителя, полученного из другого заместителя.
Хромат-ион сам является окислителем, в кислой среде он переходит в дихромат-ион, который тоже является окислителем. Оба иона удобно определять иодометрически. При анализе катионов, не проявляющих окислительно-восстановительные свойства, но образующих нерастворимые хроматы, поступают следующим образом. Осаждают ион металла в виде хромата, растворяют осадок в кислоте. Затем продукт реакции –  – определяют иодометрически как любой другой окислитель:
– определяют иодометрически как любой другой окислитель:
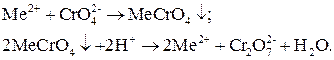
Эта схема анализа основана на многократном замещении аналита другими веществами и титровании последнего заместителя.
Определение кислот
Оно основано на реакции Ландóльта (взаимодействие кислоты с иодид-иодатной смесью):

После проведения этой реакции оттитровывают выделившийся йод раствором тиосульфата. По закону эквивалентов:

Схемы анализа
1. Если кислота сильная, то к ней добавляют смесь KI и KIO3, затем титруют выделившийся I2 раствором Na2S2O3.
2. Если кислота слабая, то реакция Ландольта идет медленно, равновесие смещено влево. Поэтому, чтобы сместить равновесие в требуемом направлении, применяют обратное титрование выделившегося I2:
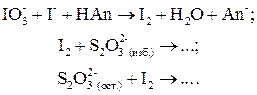
Определение органических веществ
Для определения органических веществ в иодометрии можно использовать все способы титрования.
1. Прямое титрование органического вещества-аналита стандартным раствором I2. Так определяют, например, аскорбиновую кислоту, метамизол-натрий (анальгин) и др.
2. Обратное титрование остатка I2 после реакции с органическим веществом раствором Na2S2O3 используют чаще всего:
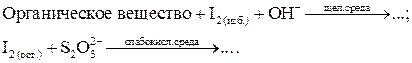
Особенность этого титрования заключается в следующем. В кислых растворах I2 не реагирует с органическими веществами или реагирует очень медленно. Поэтому сначала проводят реакцию в щелочной среде, затем раствор подкисляют и титруют.
Обратное иодометрическое титрование применяется для определения содержания:
§ альдегидов (формальдегид, хлоралгидрат, глюкоза и др.);
§ веществ, вступающих в иодоформную реакцию (ацетон и др.);
§ гидразидов (противотуберкулезное лекарственное средство изониазид и др.);
§ семикарбазидов (фурацилин и др.);
§ тиоэфиров (аминокислота метионин и др.);
§ пенициллина, антипирина, кофеина и других веществ.
В ряде случаев обратного титрования органических веществ происходит не обычное окисление их иодом, а протекают другие процессы. Например, иодометрическое определение антипирина основано на реакции электрофильного замещения атома водорода из цикла на атом иода. После проведения этой реакции оттитровывают остаток I2. Кофеин и некоторые другие алкалоиды, а также органические вещества катионного характера при взаимодействии с I2 в присутствии иодид-ионов образуют малорастворимые полииодиды. Осадок отделяют от раствора и титруют в фильтрате непрореагировавший I2.
3. Титрование заместителя используют, если органическое вещество обладает свойствами окислителя (органические пероксиды, др.).
В некоторых случаях иодометрически можно определить те органические вещества, которые взаимодействуют с ионами Cu2+. Например, никотиновую кислоту переводят в натриевую соль, которая образует с ионами Cu2+ малорастворимое комплексное соединение. Остаток Cu2+ определяют иодометрически по обычной схеме заместительного титрования.






