Перманганатометрически можно проводить определение многих веществ, которые подразделяют на 4 группы:
§ восстановители (Fe2+, S2O32–, SO32–, H2O2, HCOOH, HCOH, общая окисляемость воды и почвы и др.);
§ окислители (Cr2O72– и др.);
§ вещества, не обладающие окислительно-восстановительными свойствами, но реагирующие с C2O42– (Ca2+, Mg2+, Ba2+, Zn2+, Ni2+, Co2+ и др.);
§ органические вещества, которые титруются в щелочной среде (спирты, альдегиды, карбоновые кислоты и др.).
Определение веществ, принадлежащих к разным группам, проводится по разным схемам.
Надо отметить, что перманганатометрическое титрование, в отличие от иодометрического, сравнительно редко используется для определения органических веществ. Взаимодействие KMnO4 с органическими веществами, особенно в кислой среде, протекает очень сложно, медленно и затрагивает не какую-то определенную функциональную группу, а всю органическую молекулу в целом. Именно поэтому перманганатометрическое определение органических веществ обычно проводят в щелочной среде.
Перманганатометрическое титрование не находит широкого применения также в фармацевтическом анализе, поскольку большинство лекарственных веществ имеют органическую природу. Основными объектами, анализируемыми перманганатометрически, среди лекарственных средств являются растворы пероксида водорода. Перманганатометрия является фармакопейным методом.
Определение восстановителей
Поскольку KMnO4, будучи окислителем, взаимодействует с восстановителями, то для их определения используется либо прямое, либо обратное титрование.
Прямое титрование восстановителей раствором KMnO4 в кислой среде применяют, если реакция идет быстро.
Обратное титрование избытка KMnO4 раствором H2C2O4 применяют, если реакция между KMnO4 и восстановителем идет медленно, чаще – для органических веществ. Определение проводят в соответствии со схемой:

Определение окислителей
Поскольку KMnO4 сам является окислителем, то он не взаимодействует с другими окислителями. Следовательно, прямое титрование окислителей раствором KMnO4 провести невозможно и надо использовать другие способы титрования – обратное или заместительное титрование.
В обоих случаях сначала проводят реакцию между определяемым окислителем и каким-либо подходящим восстановителем, а затем титруют раствором KMnO4 либо остаток восстановителя после реакции (обратное титрование), либо продукт реакции – восстановленную форму определяемого вещества (титрование заместителя).
Например, в качестве второго рабочего раствора часто используют стандартный раствор соли железа (II). В этом случае обратное титрование избытка восстановителя Fe2+ раствором KMnO4 проводят по схеме:
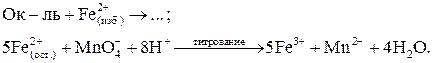
При титровании заместителя в качестве рабочего раствора используют раствор KMnO4, а в качестве вспомогательного – раствор подходящего восстановителя. Например, для определения окислителя Fe3+ к нему добавляют вспомогательный раствор Sn2+, затем титруют продукт Fe2+ раствором KMnO4:

Определение веществ, не обладающих
окислительно-восстановительными свойствами
Ионы металлов осаждают в виде оксалатов, затем титруют раствором KMnO4 связанные с металлом оксалат-ионы (титрование заместителя) либо остаток оксалата после реакции с металлом (обратное титрование).
Титрование заместителя проводят по схеме:

В этом случае раствор оксалата или щавелевой кислоты является вспомогательным раствором.
При обратном титровании используют два стандартных раствора – раствор оксалата или щавелевой кислоты и раствор перманганата. Определение проводят по схеме:

Определение органических веществ
в щелочной среде
В щелочной среде органические вещества окисляются перманганатом до карбонатов (полное окисление) или до других продуктов (неполное окисление). Эти реакции идут очень медленно, поэтому прямое титрование провести невозможно и используют обратное титрование остатка перманганата стандартным раствором оксалата или щавелевой кислоты:

Недостаток этой схемы анализа заключается в том, что визуально трудно зафиксировать к. т. т. Действительно, образуется манганат  зеленого цвета, остается перманганат
зеленого цвета, остается перманганат  фиолетового цвета, может выпасть бурый осадок MnO2, идут реакции диспропорционирования с участием марганца в различных степенях окисления.
фиолетового цвета, может выпасть бурый осадок MnO2, идут реакции диспропорционирования с участием марганца в различных степенях окисления.
Избежать этих затруднений помогает «двойное» обратное титрование: после проведения реакции (1) раствор подкисляют, добавляют избыток H2C2O4 и затем титруют остаток ее раствором KMnO4:

Иодометрия






