Метод кислотно-оснóвного титрованияоснован на реакциях кислотно-оснóвного взаимодействия. В зависимости от применяемых титрантов различают две разновидности метода:
§ алкалиметрия – рабочими растворами являются растворы сильных оснований (NаОН, KОН и др.);
§ ацидиметрия – рабочими растворами являются растворы сильных кислот (HCl, Н2SO4 и др.).
Рабочие растворы метода чаще всего готовят с молярной концентрацией эквивалента вещества от 0,05 до 0,1 моль/л.
Для определения точной концентрации рабочих растворов (стандартизации) используют установочные вещества – химически чистые соединения известного состава, реагирующие с кислотой или с основанием в стехиометрических соотношениях (например, тетраборат натрия Na2B4O7 × 10H2O, карбонат натрия Na2CO3, щавелевая кислота H2C2O4 × 2H2O и др.). Раствор установочного вещества готовится такой же концентрации, как и рабочий раствор.
Для фиксирования конечной точки титрования применяют индикаторы, реагирующие на изменение рН раствора: метиловый оранжевый, фенолфталеин, метиловый красный и др.
Методы кислотно-оснóвного титрования широко применяются в количественном анализе неорганических и органических веществ, обладающих кислотно-основными свойствами. Эти методы являются фармакопейными и используются при контроле качества многих лекарственных препаратов: аскорбиновой, ацетилсалициловой, глутаминовой и др. кислот; дикумарина; метионина; бетазина и т. д.
Общая характеристика метода
В основе метода лежит реакция нейтрализации:
Н+ + ОН– = Н2О.
Эта реакция идет с большой скоростью (практически мгновенно), строго стехиометрично и до конца. Таким образом, она удовлетворяет важнейшим требованиям к реакциям в титриметрии.
Рабочими растворами метода являются:
1) растворы сильных кислот – HCl, HNO3 (применяют при определении фосфора), H2SO4 и HClO4 (применяют, когда прибегают к кипячению анализируемых растворов) и др.
Рабочие растворы кислот устойчивы, могут храниться довольно долго. Их можно приготовить как первичные стандартные растворы из фиксанала либо как вторичные стандартные растворы путем разбавления более концентрированных с последующей стандартизацией по установочным веществам Na2СО3, Na2B4O7 · 10H2O и др.;
2) растворы сильных оснований (щелочей) – NaOH, KOH и др.
Растворы щелочей устойчивы, но они взаимодействуют со стеклом и поглощают СО2 из воздуха, поэтому их не хранят в стеклянной посуде и закрывают склянки пробками с поглотительными трубками. Их можно приготовить как первичные стандартные растворы из фиксанала либо как вторичные стандартные растворы из кристаллических препаратов или путем разбавления более концентрированных растворов с последующей стандартизацией по установочным веществам Н2С2О4 · 2Н2О, бензойной кислоте, янтарной кислоте и др.
Рабочие растворы метода нейтрализации обычно готовят с концентрацией от 0,01 до 1,0 моль экв/л.
Классификация методов кислотно-основного титрования проводится по применяемым титрантам и включает 2 группы методов:
1) ацидиметрия (титрантом является раствор сильной кислоты);
2) алкалиметрия (титрантом является раствор щелочи).
Фиксирование к. т. т. проводят с применением кислотно-основных индикаторов (рН-индикаторов), которые меняют свою окраску в зависимости от значения рН титруемого раствора.
Точность метода составляет 0,1–0,2%.
Аналитические возможности метода
Метод кислотно-основного титрования позволяет проводить определение многих неорганических и органических веществ различных классов с использованием всех способов титрования.
1. Способом прямого титрования определяют:
§ сильные и слабые кислоты, в том числе многоосновные и органические;
§ сильные и слабые основания, в том числе многокислотные и органические;
§ соли, образованные слабыми кислотами и/или слабыми основаниями (т. е. анионные основания и/или катионные кислоты согласно протолитической теории Бренстеда-Лоури);
§ эти вещества в смеси (раздельное либо суммарное определение компонентов).
Прямое титрование кислот и оснований обычно не вызывает практических затруднений, если сила протолита позволяет получить заметный скачок на кривой титрования.
В ряде случаев требуется проводить определение суммарного содержания протолитов. Например, определение суммарного содержания кислот или оснований является необходимой процедурой при оценке качества вод согласно германскому стандарту DIN 38 409/H7 по потреблению водами кислот и щелочей.
2. Способом обратного титрования определяют вещества, которые реагируют с кислотами или щелочами, но их прямое титрование по каким-либо причинам провести невозможно. К ним относятся:
§ малорастворимые в воде оксиды (CaO, MgO и др.) и карбонаты (СaCО3, BaCО3 и др.), которые анализируют по следующей схеме: к навеске оксида или карбоната добавляют точно отмеренный избыток стандартного раствора кислоты HCl. После завершения реакции оттитровывают остаток кислоты стандартным раствором щелочи:

§ соли аммония, которые анализируют по следующей схеме: к раствору, содержащему ионы NH4+, добавляют точно отмеренный избыток стандартного раствора щелочи. После завершения реакции и удаления аммиака оттитровывают остаток щелочи стандартным раствором: кислоты:

§ некоторые сложные эфиры, которые анализируют по следующей схеме: проводят щелочное омыление эфира точно отмеренным избытком стандартного раствора щелочи. После завершения реакции титруют остаток щелочи стандартным раствором кислоты:

§ некоторые металлы (Ca, Sr, Ba и др.), которые легко реагируют с кислотой. Для анализа используют следующую схему: к навеске металла добавляют точно отмеренный избыток стандартного раствора кислоты HCl. После завершения реакции оттитровывают остаток кислоты стандартным раствором щелочи:
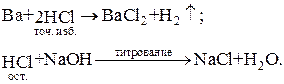
3. Способом замещения определяют вещества, которые не реагируют с кислотами или щелочами, но могут давать продукты, обладающие кислотно-основными свойствами.
Общий подход к определению таких веществ заключается в следующем. Вещество-аналит предварительно переводят в продукт, который обладает кислотными либо основными свойствами. Затем продукт (заместитель) титруют стандартным раствором кислоты или щелочи:
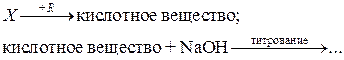
или
 .
.
Используя такой подход, можно определять следующие классы веществ:
§ некоторые органические и неорганические азотсодержащие соединения (нитриты, нитраты, нитросоединения, амины, аминокислоты и т. д.) по следующей схеме анализа: сначала переводят азот из соединения-аналита в ионы аммония NH4+ или аммиак NH3. Затем проводят обратное титрование полученных заместителей;
§ катионы и анионы с использованием ионного обмена: анализируемый раствор пропускают через колонку, заполненную ионообменным материалом – ионитом. При этом для определения катионов берут катионит в водородной форме (условно R –H), в результате на выходе из колонки получается кислота, которую титруют стандартным раствором щелочи:

а для определения анионов берут анионит в гидроксидной форме (условно R –OH), в результате на выходе из колонки получается щелочь, которую титруют стандартным раствором кислоты:

К предварительному ионному обмену часто прибегают при необходимости проведения количественного анализа на содержание так называемых «неудобных» ионов. Такие ионы не обладают химико-аналитическими свойствами, которые позволили бы легко определить их с применением химических или инструментальных методов анализа. Из катионов к ним относятся ионы щелочных металлов (Na+, K+ и др.), из анионов – NO3–, ClO3–, ClO4–, CH3COO– и др.;
§ катионы и анионы, которые образуют осадки с ионами, обладающими кислотно-основными свойствами. Например, определение катионов, которые образуют нерастворимые в воде карбонаты, проводят по схеме: осаждают карбонат металла-аналита (заместитель), затем проводят его обратное титрование:








